摘要:可能的误差 ①未及时测出最高温度--其值偏小 ②使用一个量筒且未洗干净--其值偏小 ③烧杯过大--其值偏小 巧思巧解 盖斯定律:一定条件下.某化学反应无论是一步完成还是分几步写成.反应的总热效应相同.即反应热只与始态和终态有关.而与反应的途径无关. 例:C+O2(g)== CO2(g),△H=-393.5kJ/mol CO(g)+O2(g)==CO2(g),△H=-283.0kJ/mol.求C(s)+O2(g)的反应热. 例题精析 例1 25℃.101kPa时.1g甲醇完全燃烧生成CO2和液态H2O.同时放出22.68kJ热量.下列表示该反应的热方程式正确的是 (D) A CH4O(l)+O2(g)==CO2(g)+2H2O(g),△H=-725.8kJ· mol-1 B 2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l),△H=+1451.6kJ· mol-1 C 2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l),△H=-22.68kJ· mol-1 D CH4O(l)+O2(g)==CO2(g)+2H2O(l),△H=-725.8kJ· mol-1 例2 某学生在测定强酸和强碱反应的中和热时.为了减少实验误差.采用保温杯装配成反应装置.并将酸.碱溶液的体积各增大为100mL.该学生用100mL 0.25mol/L盐酸和100mL 0.28mol/L NaOH溶液进行实验.测得中和反应前后溶液温度差的平均值为1.7℃.试回答: (1)为什么将酸.碱溶液的体积增大.可以减少实验误差? (2)实验测得的中和热为多少(假设HCl和NaOH溶液的密度均为1g· cm-3)? 产生的热量=4.18×m(aq)×△t.式中m为溶液的质量.由于未考虑容器的升温.所求热效应偏低.增加溶液的量可使容器吸相对减少.以减少误差.(56.85kJ· mol-1) 已知胆矾溶于水时溶液温度降低.室温下将1mol无水硫酸铜制成溶液时放出热量为Q1KJ.又知胆矾分解的热化学方程式为:CuSO4 5H2O CuSO4 (s)+5H2O ,△H=+Q2KJ/mol.则Q1.Q2.(Q1.Q2均大于零)的关系为 ( ) A.Q1<Q2 B Q1>Q2 C Q1=Q2 D 无法确定
网址:http://m.1010jiajiao.com/timu3_id_340997[举报]
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1 的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据:

(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
A.溶液混合后未及时盖好量热计杯盖
B.倾倒溶液太快,有少量溅出烧杯
C.溶液混合后搅拌不够
D.未等温度升到最高值就记录温度计示数
E.用量筒量取盐酸体积时仰视读数
F.烧杯和玻璃棒吸收了一部分热量
查看习题详情和答案>>
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据: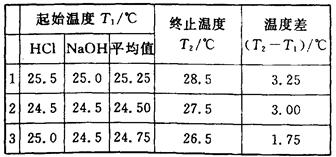
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
| A.溶液混合后未及时盖好量热计杯盖 |
| B.倾倒溶液太快,有少量溅出烧杯 |
| C.溶液混合后搅拌不够 |
| D.未等温度升到最高值就记录温度计示数 |
F.烧杯和玻璃棒吸收了一部分热量 查看习题详情和答案>>