2.四种晶体的比较
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
存在粒子 |
|
|
|
|
|
粒子间作用 |
|
|
|
|
|
熔、沸点 |
|
|
|
|
|
硬度 |
|
|
|
|
|
溶解性 |
|
|
|
|
|
导电性 |
|
|
|
|
|
实例 |
|
|
|
|
1.离子键、共价键、金属键的比较
|
|
离子键 |
共价键 |
金属键 |
|
|
极性共价键 |
非极性共健 |
|||
|
成键元素 |
活泼的金属元素 活泼的非金属元素 |
一般是不同的非金属元素之间 |
一般是同种非金属元素之间 |
同种金属元素 |
|
成健粒子 |
阴、阳离子 |
原子 |
原子 |
金属阳离子和自由电子 |
|
粒子间相互作用 |
静电作用 |
共用电子对 |
共用电子对 |
静电作用 |
|
电子式举例 |
|
|
|
|
14、A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。
五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元 素原子个比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
(1)写出元素符号:B E
(2)A元素某原子核内中子数比质子数多1,则该核素的核组成符号为 。
物质丁的分子为 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是 。
(4)已知有机物乙的分子为平面结构,碳氢键间的夹角约为120°,实验室制取乙的化学方程式为 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为 。
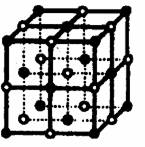 [例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
[例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是: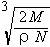 B.
B. 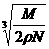
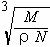 D.
D.
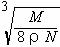
 ⑶求12克石墨的体积。
⑶求12克石墨的体积。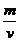 =
= 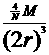 选B
选B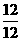 ×6.02×1023÷2=3.01×1023 (个)
×6.02×1023÷2=3.01×1023 (个) =2.28(g/cm3)
=2.28(g/cm3)