网址:http://m.1010jiajiao.com/timu3_id_340357[举报]

某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品.
(1)完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
(3)该同学取该食盐样品100g完全溶解于水中,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,则反应的离子方程式为
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液.总反应方程式为
KI+3H2O
| ||
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
工业CuSO4
| Ⅰ |
| Ⅱ |
| Ⅲ |
(1)步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是
(2)步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①这一步骤的目的是
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是
(3)步骤Ⅲ的目的是得到CuSO4?5H2O晶体,操作是
㈡探究氧化铜性质
(1)取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是
(2)为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为

(10分)(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物质未标出)。回答下列问题:
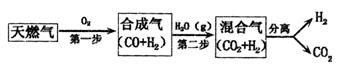
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)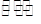 CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
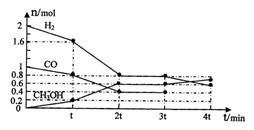
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是 ;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。
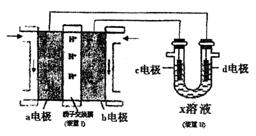
①装置Ⅰ中、H+向 极(填“a”或“b”)移动;b电极上发生的反应为 。
②铜的相对原子质量的表达式为 (用m和V1的代数式表示)。

查看习题详情和答案>>
(10分)(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是 ;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。
①装置Ⅰ中、H+向 极(填“a”或“b”)移动;b电极上发生的反应为 。
②铜的相对原子质量的表达式为 (用m和V1的代数式表示)。
查看习题详情和答案>>
(10分)(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是 ;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。
①装置Ⅰ中、H+向 极(填“a”或“b”)移动;b电极上发生的反应为 。
②铜的相对原子质量的表达式为 (用m和V1的代数式表示)。
查看习题详情和答案>>