17.(7分)(1)将40 g NaOH溶于水,配成250 mL溶液甲,甲的浓度为 mol/L(将正确选项的标号填入空格,下同).将50 mL甲加水稀释至100 mL后,得溶液乙,乙的浓度为 mol/L.将10 mL乙溶液与质量分数为9%、密度为1.11 g/cm3的NaOH溶液10 mL混合,该混合溶液丙的浓度为 mol/L(忽略溶液体积变化).混合溶液丙能与 mL 0.5 mol/L的盐酸恰好完全中和.
|
选项 |
|
|
|
|
A.4 |
B.1 |
C.2 |
D.90 |
|
E.45 |
F.35 |
G.4 .25 |
H.2.25 |
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是 ,X的相对原子质量是 .
解析:(1)n(NaOH)==1 mol,
c(甲)==4 mol/L;
c(乙)==2 mol/L;
c(丙)=
=2.25mol/L,丙中NaOH的物质的量等于HCl的物质的量,n(HCl)=2.25 mol/L×0.02 L=0.045 mol,
V[HCl(aq)]==0.09 L(即90 mL).
(2)n(Na2X)=n(Na+)=×0.4 mol=0.2 mol,M(Na2X)==62 g/mol,M(X)=62 g/mol-2×23 g/mol=16 g/mol,
因此,X的相对原子质量为16.
答案:(1)A C H D (2)62 g/mol 16
14.下列叙述正确的是 ( )
A.与28 g CO具有相同分子数的CO2的质量一定是44 g
B.与V L CO具有相同分子数的CO2的体积一定是V L
C.所含原子数相等的CO与CO2的密度之比为7∶11
D.所含原子数相等的CO与CO2的密度之比为21∶22
解析:A项:根据公式=n=,可列式:=,可判断A项正确.B、C、D都未指明两种气体所处的温度和压强是否相同,所以说法都不正确.
答案:A
|
硫酸化学纯(CP) (500 mL) 品名:硫酸 化学式:H?2SO?4 相对分子质量:98 密度:1.84 g/cm?3 质量分数:98% |
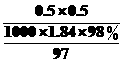 L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻
L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻