第一步:设未知数;
第二步:写出化学方程式;
第三步:写出相关物质的质量关系,写出已知量和未知量;
第四步:列比例式,求解;
第五步:写出简明的答案。
师生互动
根据化学方程式计算需注意的问题
探究:要正确地进行化学方程式的计算需注意以下几点:
(1)化学方程式是化学计算的依据,因此必须书写正确,并且一定要配平,未配平的化学方程式计算出来的量是不正确的。
(2)根据化学反应方程式求出的质量比是纯物质间的质量比,所以代入化学方程式计算的必须是纯物质的质量。
(3)当题目给出量的单位不统一时,一定要换算成统一单位。
(4)关于计算的精确值,若题目中没有要求,一般应保留一位小数。
(5)解题过程要完整规范。关于化学方程式的计算,要认真审题分清题意,找出哪些是已知量,哪些是已知关系,哪些是未知量,已知量和未知量之间有什么关系,也就是发生了什么反应,属于哪种类型的计算,需进行哪些换算,该题的突破口在哪里。通过分析整理出清晰的解题思路,并根据思路完整规范地解题。
[例题]某同学发现养鱼师傅向鱼塘中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO2),是为了解决鱼塘中氧气不足的问题。他回家后查阅资料,查到过氧化钠与水反应的原理:2Na2O2+2H2O====4NaOH+O2↑,且CaO2与Na2O2的化学性质非常相似。
(1)写出CaO2与H2O反应的化学方程式_________________________________________。
(2)该同学为测定这种固体中CaO2的质量分数,称取20 g样品加入到足量的水中,结果生成3.2 g O2(假设样品中其他成分与水不反应)。请你帮助计算该样品中CaO2的质量分数。
解析:要求CaO2的质量分数,应先求出CaO2在样品中的质量,这一质量可借助化学方程式中生成氧气的质量求得。
设20 g样品中CaO2的质量为x,
2CaO2+2H2O====2Ca(OH)2+O2↑
144 32
x 3.2g
144∶32=x∶3.2 g
x=14.4 g
该样品中CaO2的质量分数为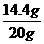 ×100%=72%。
×100%=72%。
答案:(1)2CaO2+2H2O====2Ca(OH)2+ O2↑ (2)72%
绿色通道:本题以实际生活中的信息为蓝本,综合考查了化学方程式的书写和化学方程式的有关计算。在解题时应注意代入化学方程式中计算的数据必须是参加反应的纯净物,在本题中应是生成氧气的质量,同时还应注意解题格式的规范和计算结果的准确性。
针对训练:
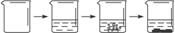
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
|
实验步骤 |
①称取烧杯的质量 |
②将适量盐酸加入烧杯中并称重 |
③称取少量石灰石样品,加入烧杯中,使之与过量稀盐酸反应 |
④待反应完全后,称重 |
|
实验图示 |
 |
|||
|
实验数据 |
烧杯的质量为50.0
g |
烧杯和盐酸的质量为100.0
g |
石灰石样品的质量为12.0
g |
烧杯和其中混合物的质量为107.6 g |
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应,也不溶于水)
解析:本题是质量守恒定律与化学方程式相结合的计算。解题时一定注意,代入化学方程式中计算的数据必须是参加反应的纯净物,要结合质量守恒定律求出二氧化碳的质量,从而根据化学方程式求出碳酸钙的质量。
(1)根据质量守恒定律得:m(CO2)=(100.0 g+12.0 g)-107.6 g=4.4 g。
(2)设12.0 g石灰石样品中含CaCO3质量为x,
CaCO3+2HCl====CaCl2+CO2↑+H2O
100 44
x 4.4 g
x=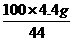 =10.0 g
=10.0 g
该石灰石样品的纯度为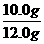 ×100%=83.3%(或83%)
×100%=83.3%(或83%)
因83.3%<85%,所以该石灰石样品的纯度不符合要求。
答案:(1)4.4 g (2)不符合要求

 锰酸钾+二氧化锰+氧气 A
锰酸钾+二氧化锰+氧气 A