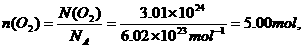3.归纳1mol不同固态物质和液态物质体积的特点并分析其形成差异的主要原因
Ⅰ对于固态物质和液态物质来说,1 mol不同物质的体积一般是不同的(如图3-2所示).
Ⅱ决定物质的体积大小有三大因素.
(1)物质粒子数的多少.
(2)物质粒子之间距离的大小.
(3)物质粒子的大小(直径为d).
Ⅲ形成差异的主要原因.
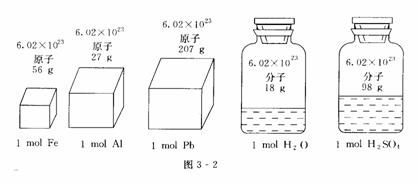
构成液态、固态物质的粒子间的距离是很小的,在粒子数相同的条件下,固态、液态物质的体积主要决定于原子、分子或离子本身的大小;由于构成不同,物质的原子、分子或离子的大小也是不同的,所以它们1 mol的体积也就有所不同(如图 3-3所示).
知识详解
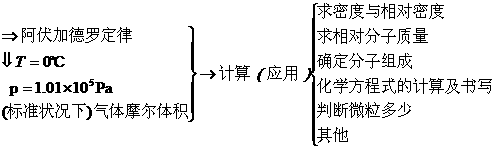
知识点1 气体摩尔体积(重点、难点)
Ⅰ决定气体体积大小的主要因素
(1)决定气体所含有的分子数(或气体的物质的量).
在一定温度,一定压强下,气体中所含的分子数目(或物质的量)越多,气体的体积就越大.
(2)分子的直径和分子之间的距离.
 一般来说,气体分子的直径约为0.4 nm,而分子之间的距离则约为4 nm,即分子之间的距离约是分子直径的10倍.因此,当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小(如图3-4所示).
一般来说,气体分子的直径约为0.4 nm,而分子之间的距离则约为4 nm,即分子之间的距离约是分子直径的10倍.因此,当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小(如图3-4所示).
思维拓展 如图3-5与图3-6所示,讨论气体分子之间的距离受哪些因素的影响?是怎样影响的?
点拨 受温度和压强的影响。一定质量的气体,当温度升高时,气体分子之间的距离增大,体积变大,当温度降低时,气体分子之间的距离减小,体积变小;当压强增大时,气体分子之间的距离减小,体积变小,当压强减小时,气体分子之间的距离增大,体积变大;当温度和压强一定时,气体分子之间的平均距离大小几乎是一定值,故粒子数是一定值,其体积是一定值.
[注意]要比较一定质量气体的体积,就必须要在相同的温度和压强下进行才有意义.
Ⅱ1 mol不同气体在标准状况下的体积(见下表)
1 mol不同气体在标准状况下的体积
|
物质 |
1 mol该物质的质量 |
密度 |
1 mol该物质所具有的体积 |
|
H2 |
2.016g |
0.0899g/L(标准状况) |
22.4L |
|
O2 |
32.00g |
1.429g/L(标准状况) |
22.4L |
|
CO2 |
44.01g |
1.977g/L(标准状况) |
22.3L |
 结论:在标准状况下,1
mol任何气体所占的体积都约为22.4 L.
结论:在标准状况下,1
mol任何气体所占的体积都约为22.4 L.
Ⅲ气体摩尔体积
(1)概念:单位物质的量的气体所占的体积叫做气体摩尔体积.
(2)符号:Vm.
(3)计算关系式:Vm=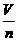 .
.
(4)单位:L/mol或m3/mol.
(5)特定条件(标准状况)下的数值22.4 L/mol或2.24×10-2m3/mol(如图3-7所示).
(6)对象:气体中任何一种单一组分的气体或不相互反应的混合气体.
(7)标准状况下的气体摩尔体积,与常温、常压下固、液体摩尔体积的比较与分析(见下表).
|
|
标准状况下,气体摩尔体积(L/mol) |
常温、常压下,固、液体摩尔体积(cm3/mol) |
|
|
体积比较 |
体积近似,约为22.4
L/mol |
体积各异 |
|
|
分析 |
特点 |
气体粒子大小<粒子间平均距离 |
固、液体粒子大小>粒子间平均距离 |
|
影响体积的因素 |
粒子间的平均距离 标准状况下,各种气体的粒子间平均距离近似,故体积近似 |
粒子的大小 常温、常压下,各固、液态的粒子的大小各异,故体积各异 |
思维误区 气体摩尔体积的特定值约是22.4L/mol,该数值与气体物质的量、温度和压强三者的任意一项都有直接的关系,观察下表中的数值并思考整理,正确理解“22.4 L/mol”的含义.
|
气体物质的量 |
气体温度 |
气体压强 |
气体体积 |
|
1 mol |
0℃ |
101 kPa |
22.4L |
|
1 mol |
40℃ |
101 kPa |
25.7L>22.4L |
|
1 mol |
0℃ |
2×101kPa |
11.2L<22.4 L |
|
2 mol |
0℃ |
101 kPa |
44.8L>22.4L |
|
1 mol |
40℃ |
116 kPa |
22.4L |
|
0.5mol |
0℃ |
50.5kPa |
22.4L |
点拨 在标准状况下,1 mol任何气体的体积都(约)为22.4 L,在标准状况下的气体摩尔体积(约)为22.4 L/mol;在非标准状况下,1 mol任何气体的体积不一定为22.4 L,但也有可能为22.4 L的气体摩尔体积(约)为22.4 L/mol;在非标准状况下,1 mol任何气体的体积不一定为22.4L,但也有可能为22.4 L.
[说明]在回答有关概念性的问题时,“22.4L”或“22.4L/mol”之前要加一个“约”字,在解答有关计算的问题时,这个“约”字可以略去.气体摩尔体积描述的对象,可以是任何一种单一组分的气体或不相互反应的混合气体.
例如:下列说法中,正确的是 ( )
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4L
D.在标准状况下,22.4L由N2和N2O组成的混合气体中所含有的N的物质的量约为2 mol
(分析) 本题主要考查对气体摩尔体积的理解和应用能力.
A项中没有明确温度和压强,无法比较,无法确定气体的体积;B项中气体摩尔体积的单位不是“L”,而是“L/mol”或“m3/mol”;C项中在标准状况下H2O为冰状,1 mol冰的体积远远小于22.4 L;D项中该气体的物质的量约为1 mol,再结合N2、N2O的分子组成可知,N的物质的量约为2 mol.
答案:D
又如:下列叙述中,不正确的是 ( )
A.1 mol任何气体所占的体积,都约为22.4L.
B.在标准状况下,任何气体的摩尔体积都约为22.4 L
C.在标准状况下,1 L任何气体所含该气体的粒子数约为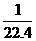 ×6.02×1023
×6.02×1023
D.0.1 mol CO,0.2mol CO2,0.3 molO2,0.4 mol N2组成的混合气体,在标准状况下,占有的体积约为22.4 L
(分析) A项没指明“标准状况”;B项中气体摩尔体积的单位应是L/mol.
答案:AB
再如:0.17g某气体在标准状况下的体积是100 mL,这种气体的相对分子质量是_____.
(分析) 在标准状况下,设22.4 L某气体的质量为x,得0.17 g:0.1 L=x:22.4L,x=38.08g,即标准状况下,22.4L某气体的质量为38.08g,该气体的摩尔质量为38.08g/mol,它的相对分子质量是38.08.
答案:38.08
还如:下列数量的各物质中所含的原子数按由大到小的顺序排列,正确的是 ( )
①0.5mol氨气;②标准状况下22.4L氦;③4℃时9mL水;④0.2mol磷酸钠
A.①④③② B.④③②①
C.②③④① D.①④②③
(分析) 本题把气体摩尔体积、物质的量、物质的质量等物理量融合在一起考查,解题步骤是:①把所有物理量换算戍物质的量;②计算每摩尔物质所含的原子数;③求出题中每种物质所含的原子数.
①0.5 molNH3中所含的原子的物质的量:0.5mol×4=2 mol;
②22.4L氦中所含的原子的物质的量: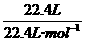 ×1=1 mol;
×1=1 mol;
③9 mL水中所含的原于的物质的量:9 mL×1 g/ml÷18 g/mol×3=1.5 mol;
④0.2 mol磷酸钠(Na3PO4)中所舍的原子的物质的量:0.2 mol×8=1.6 mol.
比较①②③④的计算结果可得答案.
答案:A
[说明] 物质的量是计算中心,解题比较关键的一步是先把微粒数、气体的体积、物质的质量等有关数据转换成物质的量,然后再进行比较.
Ⅳ阿伏加德罗定律(难点)
通过学习气体摩尔体积的概念可知,气体的体积主要决定于组成气体的分子数目和分子之间的平均距离,而分子之间的平均距离又受气体的温度和压强的直接影响.所含分子数日相同的气体,在同温、同压下,分子之间的平均距离基本相等,因此,在相同温度和相同压强下,所含分子数目相同的任意气体的体积相同.同理,在相同 温度和相同压强下,相同体积的任意气体都含有相同数目的分子,这个规律叫做阿伏加德罗定律.
[说明] ①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体.
②同温、同压、同体积和问分子数。四“同”共同存在,相互制约,只要有三个“同”成立,第四个“同”必定成立,称作“三同定一同”.
③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例.(明确规定了温度为0℃和压强为101 kPa)
Ⅴ阿伏加德罗定律的推论(难点)
根据阿伏加德罗定律,限定不同的条件。便可得到阿伏加德罗定律的多种形式(推论),熟练地掌握它们,在解答有关问题时,可达到事中功倍的效果.
 (1)推论Ⅰ:同温、同压下,气体体积与物质的量成正比;或气体密度与式量成正比.
(1)推论Ⅰ:同温、同压下,气体体积与物质的量成正比;或气体密度与式量成正比.
数学表达式: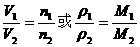 .
.
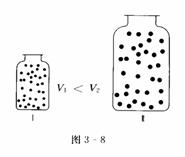
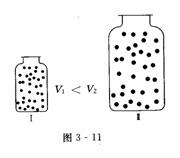
物理模型:同温、同压下,两个体积不同且装有两种不同气体的集气瓶(如图3-8所示).
例如:关于a g H2和b g He,下列说法中,正确的是 ( )
A.同温、同压下。H2与He的体积比为a:2b
B.同温、同压下,若a=b,则H2与He的物质的量之比为2:1
C.体积相同时,He的质量一定大于H2的质量
D.同温、同压下,若二者的物质的量相同,其体积也相同
(分析) A项中两种气体的体积比等于它们的物质的量之比,即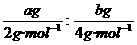 =2a:b,B项正确;C项中如果仅知道两种气体的体积相同,无法判断出
=2a:b,B项正确;C项中如果仅知道两种气体的体积相同,无法判断出
二者的物质的量的多少,也就很难判断出质量的大小,因为两种气体所处的温度、压强不一定相等,因而体积相同时,物质的量不一定相同;D项中相同温度、相同压强、相同物质的量的气体,体积一定相同.
答案:BD
又如:在相同温度和压强下,1体积氯化氢和9体积水蒸气组成的混合气体,完全冷凝后所得盐酸中HCl的质量分数是 ( )
A.10% B.18.4% C.4.9×10-4% D.80.2%
(分析) 根据阿伏加德罗定律的推论可知,同温、同压下气体体积比等于其物质的量之比,设HCl、H2O(气)的物质的量分别为1 mol,9 mol,然后将物质的量换算成质量,则可求出盐酸中HCl的质量分数.
W(HCl)= 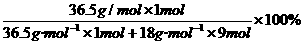
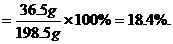
答案:B
[说明] 阿伏加德罗定律及其推论在解答有关气体的化学计算题日寸特别有用,不过千万要注意使用的条件.
(1) 推论Ⅱ:同温、同体积时,气体压强与物质的量成比.
数学表达式: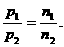
物理模型:给足球打气,进气越多.足球内压强越大(如图3-9所示).

例如:一定温度下,在两个大小相同的密闭容器中分别盛放16 g X气体和56g N2,测得两个容器内的压强分别为1.01×105 Pa和4.04×105 Pa,则X可能是什么气体?
解:因为两个容器的温度、体积分别相同,由阿伏加德罗定律的推论可知:
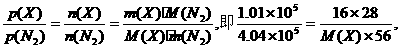
M(X)=32.X可能为O2,或某混合气体.
答:X气体可能为O2或平均式量为32的混合气体.
又如:适量的氯气与氨气先后通入一真空的密闭容器里,在一定温度下完全反应后.容器中只有氮气和氯化铵,则容器里反应前后的压强之比为 ( )
A.1:2 B.11:1 C.1:7 D.2:1
(分析) 本题涉及反应的化学方程式为:3Cl2+8NH3=N2+6NH4Cl.根据题意,假设3 mol Cl2与8 mol NH3反应,那么反应后生成的气体物质只有N2,且为 1 mol,由阿伏加德罗定律推论可知,同温、同体积时,气体压强与物质的量成正比,即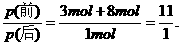
答案:B
(3)推论Ⅲ:同温、同压、同体积时,气体的质量与式量成正比.
数学表达式:
物理模型:同温、同压下两个体积相同的集气瓶中装有不同的气体(如图3-10所示).
 例如;某恒容容器的质量为50.0 g,当它充满CO2气体时,质量为58.8g,如果改装甲烷,在相同条件下,当充满甲烷时,质量为_____g.
例如;某恒容容器的质量为50.0 g,当它充满CO2气体时,质量为58.8g,如果改装甲烷,在相同条件下,当充满甲烷时,质量为_____g.
(分析) 因为是同一恒容容器,所以体积不变,又已知两次操作是在相同条件下进行,故可理解为同温、同压、同体积,由阿伏加德罗定律的推论知:
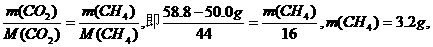
总质量:50.0 g+3.2 g=53.2 g.
答案:53.2
同类变式 在同温同压下,某瓶充满O2质量为116 g,充满CO2质量为122 g,充满气体X质量为114 g,则X的相对分子质量为 ( )
A.28 B.60 C.32 D.44
(分析) 解法1:设瓶的质量为m,根据阿伏加德罗定律,同温同压同体积的容器所盛气体的物质的量相等,可得:
(116 g-m)/32 g·mol-1=(122 g-m)/44 g·mol-1,
m=100 g.
则所盛气体的物质的量(按CO2算):
(122 g-100 g)/44 g·mol-1=0.5 mol.
再设气体X的相对分子质量为M,则有
(114g-100g)/Mg·mol-1=0.5 mol,解得 M=28.
解法2:因1 mol CO2与1 mol O2的质量之差为44 g-32 g=12 g,
所以瓶中O2的物质的量为:(122 g-116 g)/12 g·mol-1=0.5 mol.
即:CO2-O2 △m-
1 mol 12 g
n 122 g-116 g
n(O2)=0.5 mol.
根据阿伏加德罗定律,气体X的物质的量也为0.5 mol.
O2-X △m-
1 (32-M)g
 >28.9%;而C项中产生的HCl与H2O的物质的量比为1:5,形成的溶液中溶质 的质量分数为
>28.9%;而C项中产生的HCl与H2O的物质的量比为1:5,形成的溶液中溶质 的质量分数为 ×100%=28.9%,故C项正确]
×100%=28.9%,故C项正确]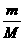 ,可知
,可知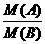 =
=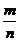 ,故A项正确;同质量A、B的分子数之比等于式量的反比,故B项正确;由阿伏加德罗定律的推论可知C项不正确,而D项正确。本题会因粗心或急于求成而出错]
,故A项正确;同质量A、B的分子数之比等于式量的反比,故B项正确;由阿伏加德罗定律的推论可知C项不正确,而D项正确。本题会因粗心或急于求成而出错]

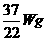 B.
B. 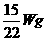 C.
C. 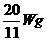 D.
D. 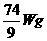
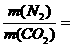
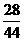 ,故m(N2)=
,故m(N2)=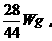 同理,m(H2)=
同理,m(H2)= 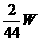 g,所以总质量为:
g,所以总质量为: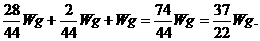
 (4)推论Ⅳ:同温、同压、同质量时,气体的体积与式量成反比.
(4)推论Ⅳ:同温、同压、同质量时,气体的体积与式量成反比.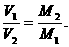
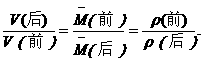
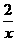 x
x
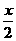
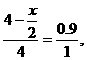 x=0.8.
x=0.8.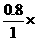 100%=80%.
100%=80%. 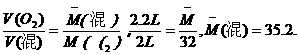
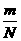 RT)推导,将化学和物理知识综合运用,不过此方程目前可只作了解,待高二物理讲完再用.
RT)推导,将化学和物理知识综合运用,不过此方程目前可只作了解,待高二物理讲完再用.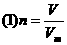
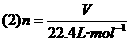
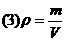
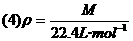
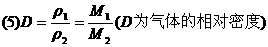
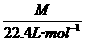 ,得M=28 g/mol,对应的常见气体有 N2和CO.
,得M=28 g/mol,对应的常见气体有 N2和CO.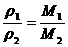 ,若能把放电后混合气体的平均相对分子质量求出,则此题就迎刃而解了.
,若能把放电后混合气体的平均相对分子质量求出,则此题就迎刃而解了.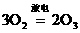
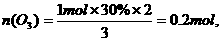
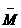 (混)=
(混)= 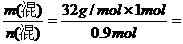 35.6g/mol,
35.6g/mol,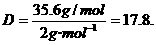
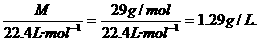
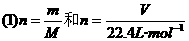 的复合:
的复合: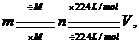
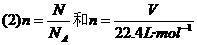 的复合:
的复合: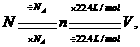
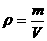 和
和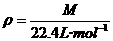 求解的,实际上,该题还可以应用复合公式
求解的,实际上,该题还可以应用复合公式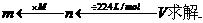
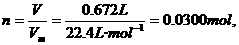
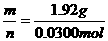 =64.0g/mol,
=64.0g/mol,