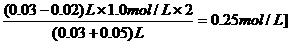2.化学式和式量
用元素符号表示物质组成的式子叫做化学式.如O2、H2O、CO2、MgO、NaCl分别表示了氧气、水、二氧化碳、氧化镁、氯化钠的组成,有的化学式仅能表示有关物质的组成,如NaCl;也有的化学式不仅能表示这种物质的组成,同时也能表示这种物质的分子构成,这种化学式也叫做分子式,如H2O既是水的化学式,也是水的分子式.
化学式中各原子的相对原子质量的总和就是式量.若化学式同时又是分子式,则式量也叫做相对分子质量.
知识详解
知识点1 摩尔
Ⅰ物质的量(重点、难点)
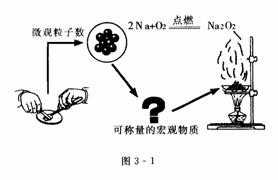
我们都知道,构成物质的基本粒子是分子、原子、离子以及质子、中子、电子等.这些单个粒子既不能用肉眼看到,又难于称量;可是由这些粒子构成的宏观物质既看得见,又可称量,那么在微观的粒子数量与可称量的宏观物质之间存在着哪些必然的联系呢?
原子是化学变化中的最小粒子,在化学反应中其数量和质量是不变的.因此,在化学反应中原子、离子、分子等粒子之间是按着一定简单整数比相互反应的.例如,豆粒般大小的金属钠中含有多少个钠原子(Na)?它们在空气中燃烧可生成多少个过氧化钠(Na2O2)?为了探索微观粒子数量与宏观物质的可称量性之间的内在联系,科学上采用“物质的量”这个物理量把一定数目的原子、分子或离子等微观粒子与可称量的物质联系起来(如图3-1所示).
[说明] 在定量表示物质的某些物理性质时,往往要使用物理量,如质量、长度、时间等,都是常用的基本物理量.与质量、长度、时间等一样,“物质的量”也是一种基本物理量.
① 物质的量是有关的国际科学专门机构,为了适应研究和学习的需要,而规定的基本物理量,它是现今国际上通用的七个基本物理量之一,这七个基本物理量的名称和代号见下表.
|
名称 |
长度 |
质量 |
时间 |
电流 |
热力学温度 |
发光强度 |
物质的量 |
|
代号 |
L或L |
M |
t |
I |
T |
I |
n |
②从物质的量设立的目的来看,物质的量实际上表示含有一定数目粒子的集体.这个集体的组成者是粒子,这种集体有大有小,也就是集体内的粒子数目有多有少;因此,物质的量是专门用于计量粒子数目的物理量.
③“物质的量”四个字如同电流强度、发光强度、热力学温度等名称一样,是一个固定的词组,由固定的字数组成,在读、写、用时,不能随意地简化或增添任何字,更不能按字面意义把物质的量当做表示物质数量或质量多少的量.
④任何一个物理量都有相应的单位,如质量的单位有千克、长度的单位有米、时间的单位有秒等.同理,物质的量也是有单位的.
Ⅱ摩尔(mol)(重点、难点)
1971年,在由41个国家参加的第十四届国际计量大会上决定用”摩尔”作为计量原子、分子或离子等微观粒子的“物质的量”的单位,摩尔又简称摩,符号为mol.
[说明] ①质量和千克是两个既有密切联系又有不同内涵的概念,质量属于物理量,千克是质量的单位.同理,物质的量和摩尔也是两个既有密切联系又有不同内涵的概念,物质的量属于物理量,摩尔是物质的量的单位.七种基本物理量都有相应的单位,具体内容见下表.
|
物理量 |
单位名称 |
单位符号 |
|
长度 |
米 |
M |
|
质量 |
千克 |
Kg |
|
时间 |
秒 |
S |
|
电流 |
安(培) |
A |
|
热力学温度 |
开(尔文) |
K |
|
物质的量 |
摩(尔) |
Mol |
|
发光强度 |
坎(德拉) |
Cd |
②“微观粒子”是指构成物质的基本单位,这一基本单位可以是分子、原子、离子、质子、中子和电子等微粒,也可以是它们的特定组合.即凡是可以使用化学式表示的微观粒子或它们的特定组合,都可以使用摩(尔)来量度,如NaCl、NH4NO3等,而不是指米粒、西瓜、苹果、汽车、人等宏观物体.
③物质的量这个物理量只适用于微观粒子,使用摩尔作单位表示物质的量时,应该用化学式指明粒子的种类,严禁指代不明确,如:可以表示1 mol H2、1 mol H、 1 mol H+,但不可以表示1 mol氢、1 mol氧等;还应明确微粒的内在联系,如1 mol Al2(SO4)3中含2 mol Al3+、3 mol SO2-4;1 mol Na+中含11 mol质子、 10 mol电子等.
① 每一个基本物理量的单位都有它的标准,如质量的单位--千克的标准是国际千克原器,即国际千克原器的质量就是1千克.“摩尔”的标准是:如果在一定量的粒子集体中所含有的粒子数与0.012 kg12C中所含有的碳原子数相同,该粒子的物质的量就是1 mol,元素相对原子质量的定义,是以12C原子的实际质量的1/12作为规定标准,由于两个标准的统一性,就将绝对质量和相对质量统一起来,从而将可称量的宏观物质同微观粒子的数目联系起来.
质量度 物理的量 粒子数

由摩尔的标准可知,1 mol任何粒子的粒子数与0.012kg12C中所含有的碳原子数都相等.
⑤碳元素的原子有多种。12C原子是原子核内有6个质子和6个中子的一种碳原子.
⑥在理论上,0.012 kg12C中所含有的碳原子数是一个客观存在且十分精确的数,在实际应用中这个数字需要通过实验测出.科学实验表明,在0.012 kg 12C中所含有的碳原子数约为6.02×1023.因此,摩尔这个物质的量的单位与其所含有的粒子数目之间的关系,常可表达为:
1 mol O中约含有6.02×1023个O;
1 mol H2O中约含有6.02×1023个H2O;
1 molNa+中约含有6.02×1023个Na+;
1 mol SO2-4中约含有6.02×1023个SO2-4;
1 mol NaOH中约含有6.02×1023个NaOH;
1 mol e-(电子)中约含有6.02×1023个e-;
即:1 mol任何粒子的粒子数目都约为6.02×1023.
Ⅲ阿伏加德罗常数(重点)
定义:1 mol任何粒子的粒子数叫做阿伏加德罗常数.
[说明] ①在“粒子的粒子数”中“粒子”二字连续出现了两次,它们所指的是同种微粒,如:1 mol O2中的O2数叫做阿伏加德罗常数,1 mol SO2-4 中的SO2-4数也叫做阿伏加德罗常数等;但1 molO2中的O数就不能叫做阿伏加德罗常数,1 mol O中的e-数也不能叫做阿伏加德罗常数等.
②符号:NA.
③数值:在理论上,阿伏加德罗常数是个客观、准确的数;但在实际上,由于受客观条件的限制,阿伏加德罗常数的准确值不能准确测出。现测定NA=6.022943×1023 mol-1.误差为1×10-6.在实际化学计算中常采用它的近似值6.02×1023 mol-1,所以NA与6.02×1023mol-1的关系如同π与3.14的关系一样.
④单位:mol-1.
⑤物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)三者之间的关系:
a.n、N与NA三者之间的函数关系式:n=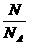 .常用于n与N之间的换算,换算的桥梁是NA.
.常用于n与N之间的换算,换算的桥梁是NA.
b.N的单位是个,有时也不用单位,n的单位是mol,NA的单位是mol-1.
c.由于微粒的种类多,组成复杂,所以在进行有关n和N之间转换的计算时,要注意微粒中还有微粒,弄清与计算相关的是哪种微粒.
例如:0.5 mol臭氧(O3)中含有O3的分子数约为______,原子数约为______,质子数约为______.
(分析) 将公式n=N NA变形,得N=n·NA,再根据1个O3分子中含3个O原子,1个O3分子中含24个质子,进行运算.习题中阿伏加德罗常数通常取6.02×1023 mol-1.
所以N(O3)=n(O3)·NA=0.5 mol×6.02×1023mol-1=3.01×1023,
N(O)=3N(O3)=3×3.01×1023=9.03×1023,
N(Z)=24N(O3)=24×3.01×1023=7.224×1024.
答案:3.01×1023;9.03×1023;7.224×1024
又如:下列叙述中,正确的是 ( )
A.物质的量及其单位--摩尔,是七个基本物理量之一
B.1 mol橘子中含有阿伏加德罗常数个橘子
C. mol任何粒子都含有阿伏加德罗常数个该种粒子
D.1 mol任何物质中都含有阿伏加德罗常数个粒子
(分析) A项错,未指明是“国际单位制”中的七个基本物理量之一;B项错,物质的量是一个表示微观粒子的物理量,宏观物质中的个体,不属于该物理量的计算范畴;C项正确,1 mol任何粒子(分子、原子、离子或电子等)都含有6.02×1023个相对应的粒子;D项错,应指明该物质所含的粒于,如1 mol H2O中所含有的原子个数不等于NA.
答案:C
知识点2 摩尔质量
Ⅰ定义:单位物质的量的物质所具有的质量叫做摩尔质量.
Ⅱ符号:M.
Ⅲ数学表达式:M=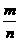 .
.
Ⅳ单位:g/mol(或g·mol-1)和kg/mol(或kg·mol-1).
Ⅴ数值:
(1)1mol微粒的质量是有规律的,下面以1mol O的质量为例进行推导.
①一个O原子与一个12C原子的质量比为
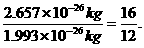
② 1 molO与1 mol12C中所含有的原子数都为NA,则有
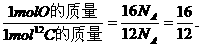
又知1 mol12C的质量为12 g,则1 molO的质量为16 g.
同理可推导:1 mol H的质量为1 g;1 mol Na的质量为23 g;mol Fe的质量为56 g;1 mol H2的质量为2 g;1 molO2的质量为32 g;1 mol H2O的质量为18g.
对于离子来说,由于电子的质量很小,当原子得到或失去电子变成离子时,电子的质量可略去不计.因此,1 mol Na+的质量为23 g,1 mol Cl-的质量为35.5 g,1 mol SO2-4的质量为96 g.
[说明] 1 mol任何粒子或物质的质量以克为单位时,在数值上都与该粒子或物质的相对原子质量或相对分子质量相等.
(2)摩尔质量的数值.
①摩尔质量的单位取g/mol时,M=Mrg/moI或M=Arg/mol.
②摩尔质量的单位取kg/mol时,M=Mr×10-3kg/mol或M=Ar×10-3kg/mol.
[说明] Mr为物质的相对分子质量,Ar为原子的相对原子质量.相对原子质量的标准是一个原子的质量与12C原子质量的1/12的比值,所以12C的相对原子质量为12,摩尔的标准正是巧选了12g12C所含的碳原子数,才有了原子摩尔质量在以 g/mol作单位时,数值上等于原子的相对原予质量的巧合出现,其他分子、离子也是如此.摩尔质量和相对原子质量、相对分子质量之间的关系分析见下表.
摩尔质量和相对原子质量,相对分子质量之间的关系
|
粒子 |
一个粒子的质量 |
1 mol(6.02×1023个)粒子的质量 |
粒子的摩尔质量 |
|
H |
1.674×10-24g |
1.674×10-24g×6.02×1023=1.0g |
1.0g/mol |
|
O |
2.657×10-24g |
2.657×10-24g×6.02×1022=16.0g |
16.0g/mol |
|
H2O |
2×1.674×10-24g+2.657×10-23g=2.992×10-23g |
2.992×10-23g×6.02×1023g=18.0g |
18.0g/mol |
例如:下列说法中,正确的是 ( )
A.物质的量相同的气体单质具有相同的原子数
B.铁原子的摩尔质量等于它的相对原子质量
C.反应前各反应物的物质的量之和一定等于反应后各生成物的物质的量之和
D.一个氧原子的实际质量等于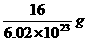
(分析) 物质的量相同的气体单质,分子数一定相同,但气体分子的组成是不同的,有的是单原子分子,如He、Ar等,有的是双原子分子,如O2、N2等,故A项错误;铁的相对原子质量为56,其单位是1,通常不写,铁的摩尔质量是56 g/mol,二者的单位不一致,故B项错误;由于反应前后元素种类不变,原子个数也不变,所以反应物的质量总和一定等于生成物的质量总和,但不同的物质其摩尔质量不同,因此,反应物的物质的量之和不一定等于生成物的物质的量之和.如H2+Cl2 2HCl,S+O2
2HCl,S+O2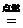 SO2,前者相等,后者不相等,故C项错误;由于1mol O的质量为16g,1 mol
O中约含有6.02×1023个O,所以个氧原子的质量为
SO2,前者相等,后者不相等,故C项错误;由于1mol O的质量为16g,1 mol
O中约含有6.02×1023个O,所以个氧原子的质量为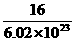 g,D项正确.
g,D项正确.
答案:D
知识点3 有关物质的量、阿伏加德罗常数、质量和微粒数目的计算 (重点、难点)
Ⅰ相关公式
(1)n=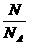 已知任意两项就可以求得第三项.
已知任意两项就可以求得第三项.
(2)M=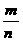 已知任意两项就可以求得第三项.
已知任意两项就可以求得第三项.
(3)m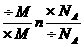 N,通过n这个桥梁进行m与N之间的换算.
N,通过n这个桥梁进行m与N之间的换算.
Ⅱ三种计算关系的解析(见下表)
|
计算关系式(公式) |
主要应用 |
注意事项 |
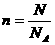 |
在n、N和NA中,已知任意两项求第三项 |
①有单位:mol-1 ②求n或N时:概念性问题用 NA;数字性问题用6.02 × 1023 mol-1,有时还要加“约”字 |
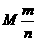 |
①在M、n和m中,已知任意两项求第三项②先求M,后求Mr |
M的单位取g/mol时,m的单位取g;M的单位取kg/mol时, m的单位取kg |
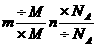 |
①
在m、M、NA和N中,已知任意三项求第四项 ②以n恒等列代数方程解决较复杂的问题 |
①
重视n在m和N之间的桥梁作用 ②与N有关的问题莫忽视微粒的组成和种类 |
例如:多少克尿素[(NH2)2CO]中所含的氮原子个数与15.8 g NH4Cl中所含的氮原子个数相同?
(分析) 若设所求的尿素的质量为x,根据公式M=mn,可求出n[(NH2) CO]和n(NH4Cl),然后根据(NH2)2CO和NH4Cl中氮的物质的量相等列代数方程,即可求解.
解:设尿素的质量为x.
尿素与氯化铵中所含的氮原子个数相同,即2n[(NH2)2CO]=n(NH4Cl).
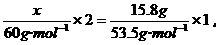
解得 x=8.86g.
答:8.86g(NH2)2CO中所含的氮原子个数与15.8gNH4Cl中所含的氮原子个数相同.
知识点4 化学方程式中量的关系(重点)
S + O2 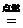 SO2
SO2
分子数之比 1 : 1 : 1
 ×3x g/mol+0.15mol×
×3x g/mol+0.15mol× ×5xg/mol+0.15mol×
×5xg/mol+0.15mol×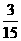 ×7x g/mol=5.36 g.
×7x g/mol=5.36 g.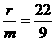 ……①,又假设参加反应的Y为a g,生成的M为b g.根据质量守恒定律可列出关系式:1.6+a=4.4+b,得a=b+2.8……②,再根据化学方程式可得:
……①,又假设参加反应的Y为a g,生成的M为b g.根据质量守恒定律可列出关系式:1.6+a=4.4+b,得a=b+2.8……②,再根据化学方程式可得: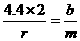 ……③,将①③两式联立,解得b=3.6,将b=3.6代入②式中,得a=6.4.所以a:b=6.4:3.6=16:9.
……③,将①③两式联立,解得b=3.6,将b=3.6代入②式中,得a=6.4.所以a:b=6.4:3.6=16:9.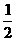 mol
CaCl2
mol
CaCl2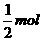
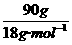 x
x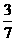 =12 mol,
=12 mol,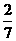 =8 mol.
=8 mol.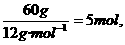
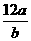 B.
B. 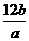 C.aNA D.bNA
C.aNA D.bNA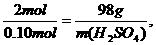
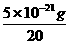 =150g,所以该该元素的摩尔质量约为150g/mol,该元素的相对原子质量约为150.
=150g,所以该该元素的摩尔质量约为150g/mol,该元素的相对原子质量约为150.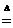 MnCl2+Cl2↑+2H2O,填写下列空白:
MnCl2+Cl2↑+2H2O,填写下列空白: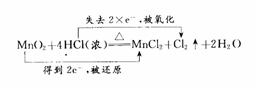
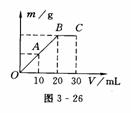 将Ba(OH)2溶液慢慢滴入50 mL 0.4 mol/L的H2SO4 溶液中,所得沉淀的质量m与碱溶液的体积V的关系如
将Ba(OH)2溶液慢慢滴入50 mL 0.4 mol/L的H2SO4 溶液中,所得沉淀的质量m与碱溶液的体积V的关系如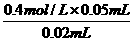 =1.0 mol/L.(2)月点时H2SO4与Ba(OH)2恰好完全反应生成BaSO4沉淀,故Ba2+的物质的量浓度为0.(3)C点时Ba(OH)2过量,c(OH-)=
=1.0 mol/L.(2)月点时H2SO4与Ba(OH)2恰好完全反应生成BaSO4沉淀,故Ba2+的物质的量浓度为0.(3)C点时Ba(OH)2过量,c(OH-)=