0 23413 23421 23427 23431 23437 23439 23443 23449 23451 23457 23463 23467 23469 23473 23479 23481 23487 23491 23493 23497 23499 23503 23505 23507 23508 23509 23511 23512 23513 23515 23517 23521 23523 23527 23529 23533 23539 23541 23547 23551 23553 23557 23563 23569 23571 23577 23581 23583 23589 23593 23599 23607 447348
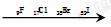
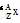 ”的形式写出α粒子的化学式并求其电子数。
”的形式写出α粒子的化学式并求其电子数。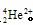 。He
。He ;电子数是0。
;电子数是0。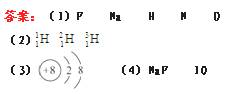

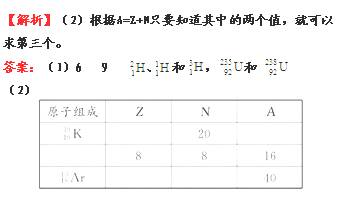
 ]
]
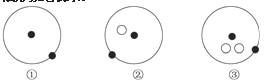


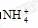 OH-
OH-