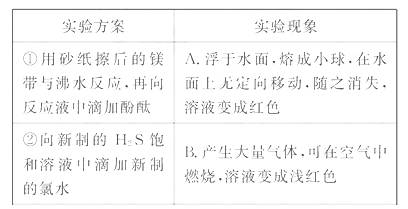
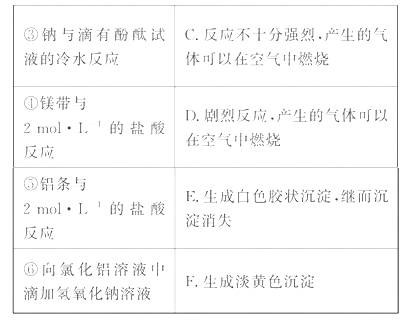
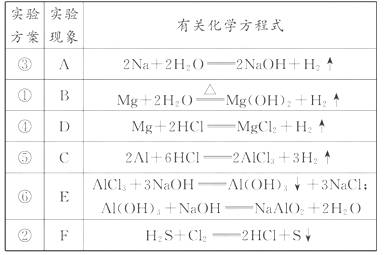
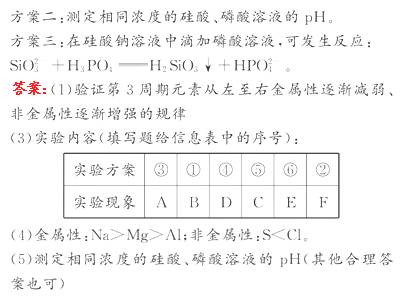
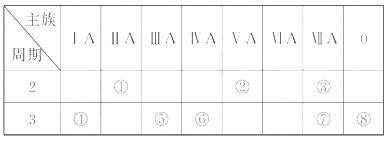
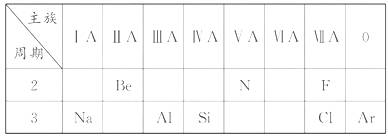
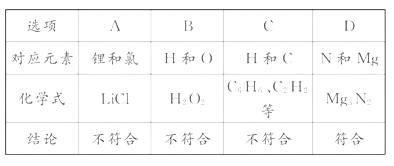
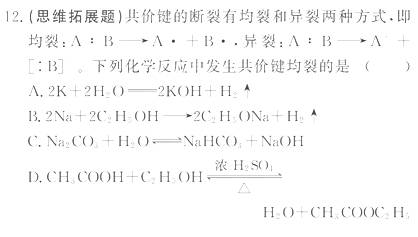
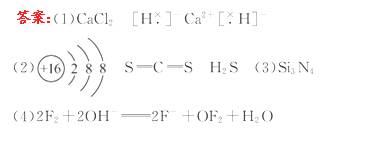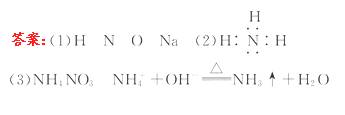0 23395 23403 23409 23413 23419 23421 23425 23431 23433 23439 23445 23449 23451 23455 23461 23463 23469 23473 23475 23479 23481 23485 23487 23489 23490 23491 23493 23494 23495 23497 23499 23503 23505 23509 23511 23515 23521 23523 23529 23533 23535 23539 23545 23551 23553 23559 23563 23565 23571 23575 23581 23589 447348