0 23376 23384 23390 23394 23400 23402 23406 23412 23414 23420 23426 23430 23432 23436 23442 23444 23450 23454 23456 23460 23462 23466 23468 23470 23471 23472 23474 23475 23476 23478 23480 23484 23486 23490 23492 23496 23502 23504 23510 23514 23516 23520 23526 23532 23534 23540 23544 23546 23552 23556 23562 23570 447348
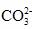
 .该燃料电池总反应为:CH4+2O2+2OH-
====
.该燃料电池总反应为:CH4+2O2+2OH-
====  关说法正确的是( )
关说法正确的是( )  生氧化反应,正极发生还原反应,充电时负极发生还原反应,而正极发生氧化反应,所以B错C对。
生氧化反应,正极发生还原反应,充电时负极发生还原反应,而正极发生氧化反应,所以B错C对。 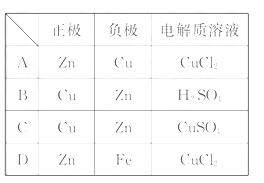
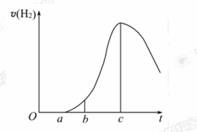
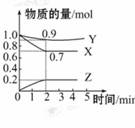
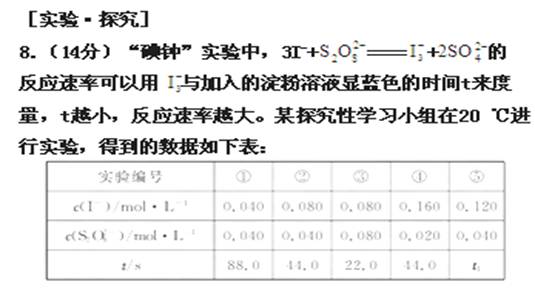 ,
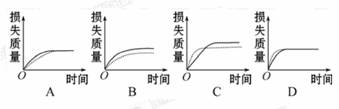
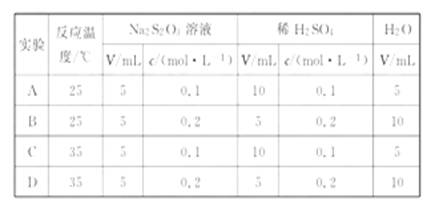
,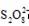 的浓度对反应速率
的浓度对反应速率