7.(10分)氢氧燃料 电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能 力强,性质稳定,
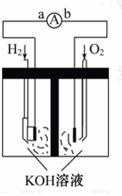
请回答:
(1)氢氧燃料电池的能量转化主要形
式是_____ ,在导线中电子流动方向
为_____ (用a、b表示)。
(2)负极反应式为_____ 。
(3)电极表面镀铂粉的原因为_____ 。
|
Ⅰ.2Li+H2====2LiH Ⅱ.LiH+H2O====LiOH+H2↑
①反应Ⅰ中的还原剂是_____ ,反应Ⅱ中的氧化剂是_____ 。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为____ 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__ mol。
[解析]本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2+O2====2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)Ⅰ.Li从零价升至+1价,作还原剂。Ⅱ.H2O的H从+1降至H2中的零价,作氧化剂。由反应Ⅰ,当吸收10 mol H2时,则生成20 mol LiH,V=m/ρ=20×7.9/0.82×10-3(L)=192.68×10-3(L)。
V(LiH)/V(H2)=192.68×10-3 L/224 L=8.6×10-4。
20 mol LiH可生成20 mol H2,实际参加反应的H2为20×80%=16 mol,1 mol H2转化成1 mol H2O,转移2 mol电子,所以16 mol H2可转移32 mol的电子。
答案:(1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e- ====4H2O或H2+2OH--2e- ====2H2O
(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率 (4)①Li H2O ②8.6×10-4 ③32
[实验·探究]
 _________________
。
_________________
。
 A族时,两元素的原子序数之差为上面元素所在周期中包含的元素种类数;
A族时,两元素的原子序数之差为上面元素所在周期中包含的元素种类数;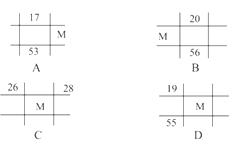
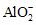
 能否发生自发的氧化还原反应
能否发生自发的氧化还原反应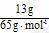 ×22.4 L·mol-1=4.48 L
×22.4 L·mol-1=4.48 L