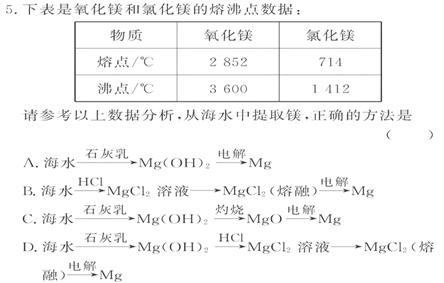
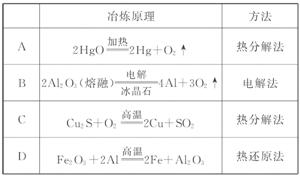
0 23445 23453 23459 23463 23469 23471 23475 23481 23483 23489 23495 23499 23501 23505 23511 23513 23519 23523 23525 23529 23531 23535 23537 23539 23540 23541 23543 23544 23545 23547 23549 23553 23555 23559 23561 23565 23571 23573 23579 23583 23585 23589 23595 23601 23603 23609 23613 23615 23621 23625 23631 23639 447348
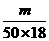 ×6.02×1023
×6.02×1023 ×6.02×1023
D.
×6.02×1023
D.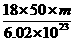
 mol,1滴水所含的水的物质的量为
mol,1滴水所含的水的物质的量为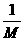 g
C.
g
C.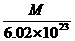 g
D.
g
D.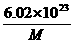 g
g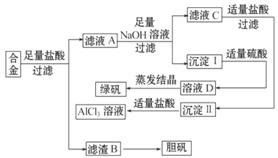
 _____
。
_____
。  H2O2可氧化。
H2O2可氧化。  8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 
 ,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。
,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。  +2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
+2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色