网址:http://m.1010jiajiao.com/timu3_id_88932[举报]
亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂.下列说法正确的是
- A.HClO2是有机酸
- B.上述反应中,ClO2是还原产物
- C.上述反应中,1 molHClO2分解转移2 mol电子
- D.上述反应中,氧化剂与还原剂物质的量之比为1∶4
|
亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂.下列说法正确的是 | |
| [ ] | |
A. |
HClO2是有机酸 |
B. |
上述反应中,ClO2是还原产物 |
C. |
上述反应中,1 mol HClO2分解转移2 mol电子 |
D. |
上述反应中,氧化剂与还原剂物质的量之比为1∶4 |
|
亚氯酸钠(NaClO2)可做漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2 | |
A. |
酸使亚氯酸的氧化性增强 |
B. |
溶液中的H+起催化作用 |
C. |
溶液中的Cl-起催化作用 |
D. |
逸出的ClO2使生成物浓度降低 |
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于工业生产的漂白及消毒。
下图是过氧化氢法生产亚氯酸钠的工艺流程图:
相关物质的性质如下:
① ClO2沸点低易气化;浓度较高的ClO2气体易分解爆炸。
② NaClO2溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
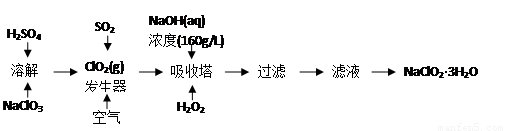
(1).在ClO2发生器中通入SO2的同时鼓入空气,其作用是________(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(2)为确保H2O2充分参与反应,吸收塔内温度不宜较高,其原因是______________。
(3)160 g·L-1 NaOH溶液的物质的量浓度为______________,在实验室若要配制450mL该物质的量浓度NaOH溶液,应称取NaOH的质量为__________克。
(4)写出吸收塔内反应的化学方程式_____________________________________。
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进一步的操作是________(填操作名称)。
查看习题详情和答案>>
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于工业生产的漂白及消毒。
下图是过氧化氢法生产亚氯酸钠的工艺流程图:
相关物质的性质如下:
① ClO2沸点低易气化;浓度较高的ClO2气体易分解爆炸。
② NaClO2溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1).在ClO2发生器中通入SO2的同时鼓入空气,其作用是________(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(2)为确保H2O2充分参与反应,吸收塔内温度不宜较高,其原因是______________。
(3)160 g·L-1 NaOH溶液的物质的量浓度为______________,在实验室若要配制450mL该物质的量浓度NaOH溶液,应称取NaOH的质量为__________克。
(4)写出吸收塔内反应的化学方程式_____________________________________。
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进一步的操作是________(填操作名称)。