20.(10分)下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
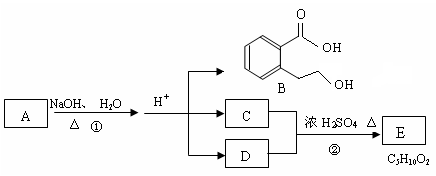
根据上图回答问题:
(1)C分子中的官能团名称是 ______________;化合物B不能发生的反应是 (填字母序号):
a 加成反应 b取代反应 c消去反应 d酯化反应 e水解反应 f 置换反应
(2)反应②的化学方程式是_________________ _。
(3)反应②实验中加热的目的是:
Ⅰ、 。;
Ⅱ、 。。
(4)A的结构简式是 __________________ 。
(5)同时符合下列三个条件的B的同分异构体的数目有 个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3 溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(6)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH
如下表:
|
实验编号 |
C物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
m |
0.1 |
0.1 |
pH=9 |
|
n |
0.2 |
0.1 |
pH<7 |
从m组情况分析,所得混合溶液中由水电离出的c(OH-)= mol·L-1。
n组混合溶液中离子浓度由大到小的顺序是 。
19.(10分)已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
e |
I |
|
原子核数 |
单核 |
两核 |
四核 |
|
粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
 物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤
都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤
都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M_____________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是___________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
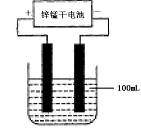
18.(原创)(10分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Na+、K+、Cu2+ |
|
阴离子 |
SO42- 、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。

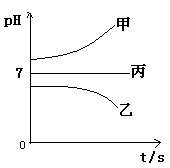
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)
电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
17.(12分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
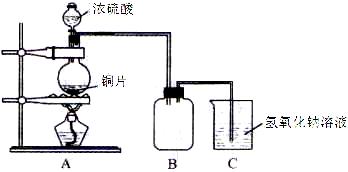
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲、乙学生进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,在计算余酸的物质的量浓度。他认为测定二氧化硫的量的方法有多种,请问下列实验方案中可行的是_______(填写编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案进行分析(可以不填满):
|
方案序号 |
分析 |
误差(偏低或偏高) |
改变措施 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)_____________________________。
16.一定条件下将质量为X g的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Y g,下列对应关系一定正确的是 ( )
|
序号 |
有机物 |
X |
Y |
|
A |
C2H4 |
m |
15m/7 |
|
B |
HCOOH |
m |
15m/23 |
|
C |
CH3OH和CH3COOH的混合物 |
m |
2m/3 |
|
D |
HCOOH与CH3COOCH3的混合物 |
m |
2m |
第Ⅱ卷(非选择题,共52分)
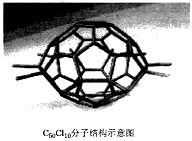 厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,
厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,
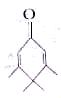
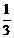 B.标准状况下,22.4L SO3中氧原子的个数约为6.02×1023
B.标准状况下,22.4L SO3中氧原子的个数约为6.02×1023