124.在一定温度下碳酸钠的溶解度为40g,向280g的饱和碳酸钠溶液中加入10.6g无水碳酸钠,搅拌静置,最终所得晶体的质量为 ( )
A.10.6g B.60.6g C.2.86g D.89.2g
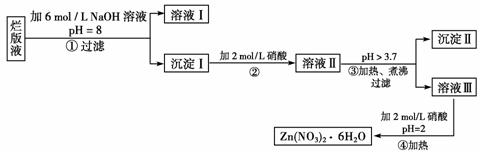
121.某中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制得白色固体就是碱石灰,它是水和二氧化碳的吸收剂”。有两个实验小组决定通过实验来探究碱石灰的组成。
(1)第一小组设计的实验方案如下:

下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是________
A. n(Na+)+ 2n(Ca2+)= n(OH-) B. 2n(Na+) + 2n(Ca2+)= n(OH-)
C. n(Na+)+ n(Ca2+)= 2n(OH-)
现有4.0g碱石灰,设其中n(Na+)= xmol, n(Ca2+)= ymol,请填写下列空格:
|
碱石灰的可能组成 |
NaOH, CaO |
NaOH, CaO, Ca(OH)2 |
NaOH, Ca(OH)2 |
NaOH, Ca(OH)2 H2O |
|
x,y之间关系式(等式或不等式) |
A |
40x+56y﹤4.0﹤ 40x+74y |
B |
C |
把表中A、C的关系式填在下面空格上:
A:__________________________C:______________________ 。
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,高于250℃时才分解;氢氧化钠在580℃时不分解。他们设计了如下方案并得出相应相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,测得固体质量又减少了0.7g.请通过计算确定该碱石灰各成分的质量分数?(要计算过程)
 将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?