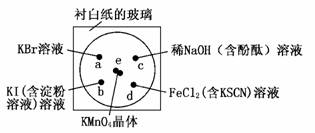
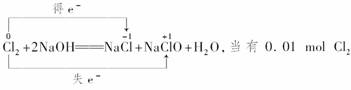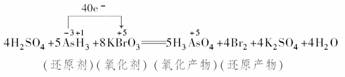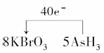4.(2009·合肥模拟)a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示
|
反应物 |
a+b |
c+d |
a+d |
a+c |
b+d |
|
现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
由上述现象可推知a、b、c、d依次是 ( )
A.HCl、BaCl2、AgNO3、Na2CO3
B.AgNO3、HCl、Na2CO3、BaCl2
C.BaCl2、Na2CO3、AgNO3、HCl
D.AgNO3、HCl、BaCl2、Na2CO3
答案:D