(一)原子的构成:
(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
(3)原子序数 = 核电核数 = 质子数 = 核外电子数
(4)质量数(A)=质子数(Z)+中子数(N)
|
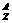 X来表示一个质量数为A,质子数为Z的具体的X原子。
X来表示一个质量数为A,质子数为Z的具体的X原子。
|
|||
 |
|||
[练习]
10.下列叙述中正确的是( )
A.氢有三种核素,即有三种氢原子
B.所有元素的原子核均由质子和中子构成
C.具有相同的核外电子数的粒子,总称为元素
D.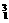 H是一种同位素
H是一种同位素
11.在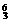 Li、
Li、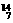 N、
N、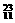 Na、
Na、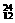 Mg、
Mg、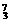 Li、
Li、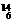 C中:
C中:
(1) 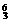 Li 和
Li 和 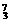 Li 互为同位素。
Li 互为同位素。
(2) 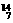 N 和
N 和 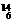 C 质量数相等,但不能互称同位素。
C 质量数相等,但不能互称同位素。
(3) 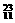 Na 和
Na 和 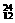 Mg 的中子数相等,但质子数不相等,所以不是同一种元素。
Mg 的中子数相等,但质子数不相等,所以不是同一种元素。

 +1 +7,中部出现负价,由-4 -1 的变化规律。
+1 +7,中部出现负价,由-4 -1 的变化规律。 填空
填空
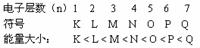
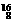
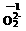 ,各数字所表示的意义是:16 质量数 、8 质子数
、
,各数字所表示的意义是:16 质量数 、8 质子数
、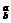 X,元素Y的一种核素
X,元素Y的一种核素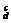 Y,已知a>c,b>d,则元素X和Y含有的中子数的大小关系为( )
Y,已知a>c,b>d,则元素X和Y含有的中子数的大小关系为( )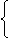 原子结构 相似性:最外层电子数相同,都为_________个
原子结构 相似性:最外层电子数相同,都为_________个