32.下面的表格是元素周期表的一部分,其中的序号对应的是元素。
|
① |
|
|
|||||||||||||||
|
|
② |
|
|
③ |
|
|
|
④ |
|||||||||
|
|
⑤ |
⑥ |
|
|
⑦ |
⑧ |
|
||||||||||
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)按原子轨道的重叠方式看,元素①③形成的相对分子的质量最小的分子中,含 键;
元素⑤和⑧形成的化合物晶体类型为 。
(2)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的气态化合物分子的空间
构型为 。
(3)表中某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为 。
(4)②④⑤⑥四种元素的第一电离能由大到小的顺序是(填序号) 。
(5)元素⑨的价电子排布式为 。
29.(16分)(I) 将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O
(g) + CO( g)  CO2
(g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2
(g) +H2(g);得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
1.2 mol |
5 min |
|
2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.8 mol |
3 min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
( 1 ) ①由以上数据,实验1中以v( CO2) 表示的反应速率为 。
②该反应在650℃时平衡常数数值为 。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t < 3min,
则a、b 应满足的关系是 。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的
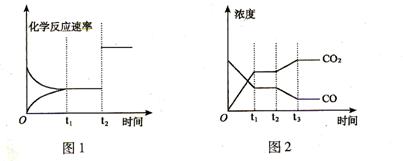 情况:
情况:
①图1中时刻t2发生改变的条件可能是 (写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是 。
(3) 在850℃时,其平衡常数K = 1,850℃时在该容器中同时充人1.0moICO,3.0 molH2O,1.0molCO2,5.0molH2,平衡时CO2的物质的量为 。
(II) 二元酸H2A的电离反应如下:H2A
 HA- + H+ K1 =
4.50×10-7 HA-
HA- + H+ K1 =
4.50×10-7 HA- A2- + H+ K2
= 4.70×10-11用0.300
mol·L-1 HCl滴定含有Na2A和NaHA的一份20.00 mL的溶液,滴定进程用玻璃电极pH计跟踪,滴定曲线上的三个点对应的数据如下:
A2- + H+ K2
= 4.70×10-11用0.300
mol·L-1 HCl滴定含有Na2A和NaHA的一份20.00 mL的溶液,滴定进程用玻璃电极pH计跟踪,滴定曲线上的三个点对应的数据如下:
|
加入的HCl/mL |
1.00 |
10.00 |
28.00 |
|
pH |
10.33 |
8.34 |
6.35 |
(1)加入1.00 mL HCl时首先与HCl反应的溶质是 ,产物是 。
(2)(1)中生成的产物有 mol。
(3)写出(1)中生成的产物与溶剂反应的主要平衡式: 。
30(14分).我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ;(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
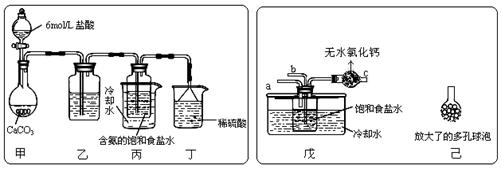
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
 后气体呈红棕色,则下列推断正确的是( )
后气体呈红棕色,则下列推断正确的是( )
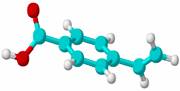 某有机物只含有C、H、O三种元素,其结构如右图所示,图中的短棍可以代表单键、双键和叁键。下列关于这种物质的说法中正确的是(
)
某有机物只含有C、H、O三种元素,其结构如右图所示,图中的短棍可以代表单键、双键和叁键。下列关于这种物质的说法中正确的是(
)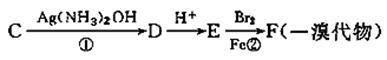 的结构只有两种。
的结构只有两种。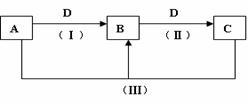 (12分)(I) A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
(12分)(I) A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题: A.H2Y的电离方程式:H2Y 2H++Y2-
A.H2Y的电离方程式:H2Y 2H++Y2-