21.选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,将按A题评分。
A.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E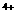 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是
。(填字母)
(2)下列叙述正确的是
。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个 键和1个
键和1个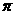 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC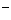 氧化成BCD
氧化成BCD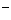 ,再在酸性条件下BCD
,再在酸性条件下BCD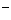 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD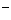 互为等电子体的分子、离子的化学式依次为
(各写1种)。
互为等电子体的分子、离子的化学式依次为
(各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
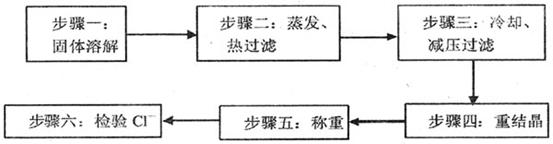
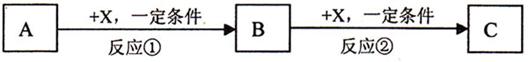
B.硝酸钾既是一种重要的工业原料又是一种优质的无氯钾氮复合肥,实验室可通过下列 所示的流程制备之。
硝酸钾等四种盐在不同温度下的溶解度(单位:g)见下表。
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
110.0 |
169 |
246 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
45.5 |
51.1 |
56.7 |
|
NaNO3 |
73 |
80 |
88 |
96 |
104 |
124 |
148 |
180 |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.3 |
38.4 |
39.8 |
请回答下列问题:
(1)该制备流程实际是工业制取硝酸钾过程的实验室再现,则步骤一所溶解的固体 是 (答物质的名称)。
(2)在步骤二中,先蒸发(通过加热、搅拌进行)使溶液浓缩,这时会有 (答 物质的名称)晶体逐渐析出;当溶液体积减少到约原来的一半时,迅速趁热过滤,但承接滤液的烧杯应预先加适量的蒸馏水,则此蒸馏水的作用是 。
(3)为便于吸滤,在安装减压过滤装置时,应使吸滤瓶的支管口与 相 对。吸滤完成后,吸滤瓶中的溶液应从 倒出。
(4)从溶液中析出的晶体颗粒的大小与结晶的条件有关。下列叙述正确的是 。(填字母)
a.在一定条件下,溶质的溶解度越小或溶液的浓度越低,析出的品粒就越细小
b.在一定条件下,溶剂的蒸发速度越慢或溶液冷却得越慢,析出的晶粒就较大
c.在一定条件下,溶质的溶解度越大或溶液冷却得越快,析出的品粒就就较大
d.当溶液过饱和时,振荡容器或向溶液中投入几粒晶体,都能促使晶体析出
(5)在步骤六对产品进行CI 检验的目的是
。
检验的目的是
。
(6)该制备硝酸钾的化学原理之一是利用不同物质的溶解度随温度的变化而发生不 同的变化,具体的说就是 。又某化工厂用KCI、HNO3溶液和O2为原料反应制备硝酸钾,同时副产C12等,则该反应的化学方程式为 。
徐州市2008-2009学年度高三第三次调研考试
 255.58 kJ·mol
255.58 kJ·mol
 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g) 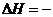 255.58kJ·mol
255.58kJ·mol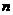 (CH3CH2OH)/
(CH3CH2OH)/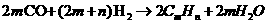
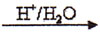 RCOOH。光学活性毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下:
RCOOH。光学活性毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下: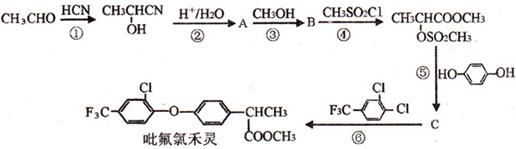
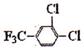 的含有三氟甲基(F3C一)和苯环的同分异构体共有
种。
的含有三氟甲基(F3C一)和苯环的同分异构体共有
种。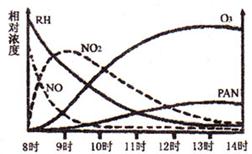 理的是
。(填字母)
理的是
。(填字母)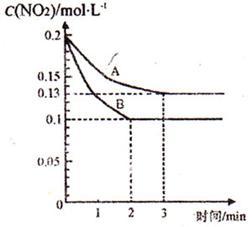 (2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NO
(2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NO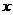 ),可利用甲烷和NO
),可利用甲烷和NO 2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答: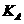
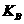 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)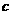 (NO2)=0.4 mol·L
(NO2)=0.4 mol·L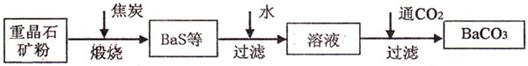
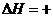 571.2 kJ·mol
571.2 kJ·mol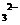 (aq)
(aq)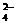 (aq)
(aq)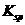 (BaCO3)=2.8×10
(BaCO3)=2.8×10 ,
, 。现欲用沉淀转化法将0.39 mol BaSO4全部转化为BaCO3,如每次用1.00 L
2.0 mol·L
。现欲用沉淀转化法将0.39 mol BaSO4全部转化为BaCO3,如每次用1.00 L
2.0 mol·L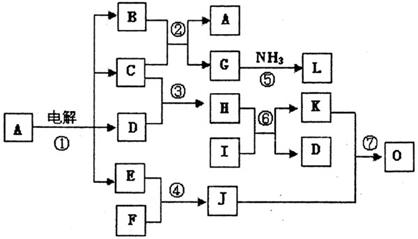 (8分)下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4。
(8分)下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4。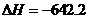 kJ/mol
kJ/mol 76℃、沸点为138℃。③ S2C12+C12
76℃、沸点为138℃。③ S2C12+C12 2SCl2。④ S2C12易和水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等。
2SCl2。④ S2C12易和水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等。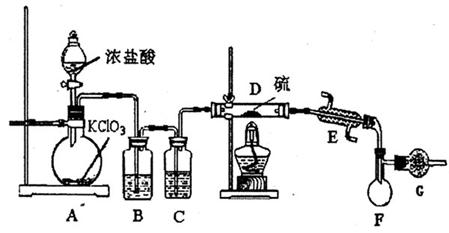
 (4)G装置的作用是
。
(4)G装置的作用是
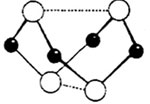
。 S4N4+8S+12NH4C1,且S4N4的结构如右图所示。若非金属性:S<N,试计算由C12制取S4N4的过程中,每消耗3 mol C12转移电子的物质的量为
。
S4N4+8S+12NH4C1,且S4N4的结构如右图所示。若非金属性:S<N,试计算由C12制取S4N4的过程中,每消耗3 mol C12转移电子的物质的量为
。
 )>
)> )
)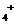 )>
)>