摘要:7.右图是778K时N2与H2反应过程中能量变化的曲线图. 下列叙述正确的是( ) A.此反应N2+3H22NH3为吸热反应 B.加入催化剂.该化学反应的DH变大 C.b曲线是加入催化剂时的能量变化曲线 D.加入催化剂可增大正反应速率.逆反应速率不变
网址:http://m.1010jiajiao.com/timu3_id_54644[举报]
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:(1)已知常温常压下,0.5molCH4在O2中完全燃烧,放出445.16kJ的热量,写出表示CH4的燃烧热的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.32kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.32kJ/mol
.(2)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是:
S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol
S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol
.(3)右图是198K时N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为:
N2(s)+3H2(g)=2NH3(g);△H=-92kJ/mol
N2(s)+3H2(g)=2NH3(g);△H=-92kJ/mol
.右图是298K时N2与H2反应过程中能量变化的曲线图。
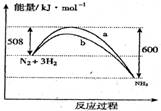
下列叙述不正确的是( )
A、该反应的热化学方程式为: N2(g)+3H2(g)?2NH3(g),△H=92KJ·mol-1
B、b曲线是加入催化剂时的能量变化曲线
C、加入催化剂,该化学反应的活化能和反应热都改变
D、在温度体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1 KJ,若通入2mol N2和 6mol H2反应后放出的热量为Q2 KJ,则184>Q2>2Q1
查看习题详情和答案>>
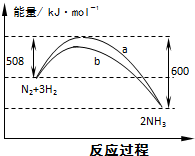 如图是778K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是778K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )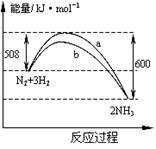
 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1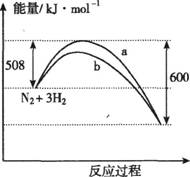
 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1