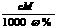考点15.有机物的分类、命名和同分异构
(1)了解有机化合物数目众多和异构现象普遍存在的本质原因。(2)理解基团、官能团、同分异构体、同系物等概念。能够识别结构式(结构简式)中各种原子的连接次序和方式、基团和官能团。能够辩认同系物和列举异构体。了解烷烃的命名原则。烷烃命名限于5个碳原子以内。
例15-1.对下列四种有机物的分析,正确的是( B )
 A.水杨酸和茉莉醛均能发生银镜反应
A.水杨酸和茉莉醛均能发生银镜反应
 B.乙酰水杨酸可以由水杨酸发生酯化反应生成
B.乙酰水杨酸可以由水杨酸发生酯化反应生成
C.四种有机物都含有碳碳双键,都能和氢气发生加成反应
D.四种机物中只有乙酰水杨酸能发生水解反应
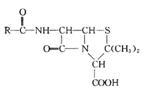
例15-2.青霉素是常用抗生素,其结构可表示为:
不同品种青霉素的结构式中,R-为不同的基团)。
 (1)阿莫西林是一种常用青霉素,它的结构式中R-为 。
(1)阿莫西林是一种常用青霉素,它的结构式中R-为 。
①阿莫西林分子中显酸性的官能团是 (填名称);
②下列关于阿莫西林的说法中,正确的是 (填标号)。
A.是高分子化合物 B.属于芳香烃
C.分子式为C16H19O5N3S D.可与浓溴水反应生成白色沉淀
(2)青霉素G(C16H18O4N2S)是一种天然青霉素,其结构式中的R一为含苯环的烃基,R-的结构可能有 种。
答案:(1)①羧基、酚羟基;②CD;(2)4
考点16.有机物的结构、性质、推断和合成
(3)以一些典型的烃类化合物为例,了解有机化合物的基本碳架结构。掌握各类烃(烷烃、烯烃、炔烃、芳香炔)中各种碳碳键、碳氢键的性质和主要化学反应,并能结合同系列原理加以应用。(4)以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油脂、多羟基醛酮、氨基酸等)为例,了解官能团在化合物中的作用。掌握各主要官能团的性质和主要化学反应。(5)了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。(6)了解在生活和生产中常见有机物的性质和用途。(7)以葡萄糖为例,了解糖类的基本组成和结构,主要性质和用途。(8)了解蛋白质的基本组成和结构,主要性质和用途。(9)初步了解重要合成材料的主要品种的主要性质和用途。理解由单体进行加聚和缩聚合成树脂的简单原理。(10)通过上述各类化合物的化学反应,掌握有机反应的主要类型。(11)综合应用各类化合物的不同性质,进行区别、鉴定、分离、提纯或推导未知物的结构简式。组合多个化合物的化学反应,合成具有指定结构简式的产物。
例16-1.已知:①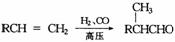 ,②
,②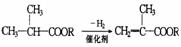
有机物A-F中,A是链烃,A与H2加成得到烷烃,经测定该烷烃分子中有三个-CH3,它的一氯取代物有7种同分异构体,F为高分子化合物,其他信息如下:
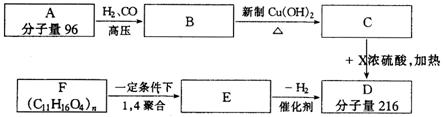
(1)写出X的结构简式:___________________________,
(2)写出化合物A、C、E的结构简式:A__________, C__________,E___________,
(3)写出B与足量的新制Cu(OH)2反应的化学方程式: _______________________。
答案:(1)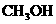
(2)A: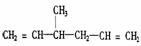 C:
C: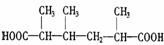
 E:
E: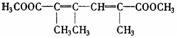
(3)
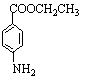 例16-2.苯佐卡因是一种局部麻醉剂,其结构简式为:
例16-2.苯佐卡因是一种局部麻醉剂,其结构简式为:
已知:① 苯环上的取代有如下定位规律:当苯环上的碳原子连有甲基时,可在其邻位或对位上引入官能团;当苯环上的碳原子连有羧基时,可在其间位上引入官能团。
②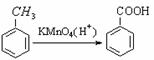 ③
③ 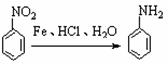
④-NH2具有较强的还原性和弱碱性。
请以甲苯、淀粉为主要原料合成苯佐卡因,用合成反应流程图表示出最合理的合成方案(注明反应条件)。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
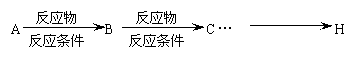
答案:
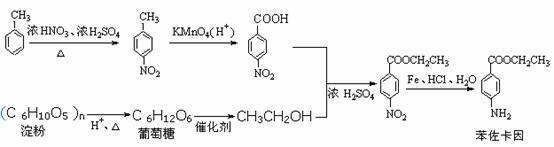
考点17.了解化学实验常用仪器的主要用途和使用方法,掌握化学实验的基本操作,了解实验室一般事故的预防和处理方法。
例17.下列实验操作或对实验事实的叙述正确的是( B )
①某无色溶液的焰色反应呈黄色,则该溶液是钠盐溶液;②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;③用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液;④用稀硝酸清洗做过银镜反应实验的试管;⑤不慎将苯酚溶液沾到皮肤上,立即用小苏打溶液清洗;⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;⑧某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+。
A.①⑤⑦ B.②④⑧ C.③④⑦⑧ D.②③⑤⑥
考点18.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法);综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别。
例18-1.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a.b.c.d表示相应仪器中加入的试剂)。
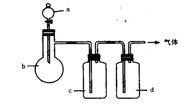
|
气体 |
a |
b |
c |
d |
|
C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
答案:(1)NO;(2)①C2H4 ,装置中没有温度计,无法控制反应温度;②Cl2,反应生成的Cl2被c中的NaOH溶液吸收了;③NH3 ,反应生成的NH3被c中的H2O吸收了。
例18-2.下列除去括号内杂质的有关操作方法不正确的是( C )
①苯(苯酚):加入NaOH溶液,分液;②乙醇(乙酸):加KOH溶液,分液;③苯(甲苯):加KMnO4/NaOH溶液,蒸馏;④乙烷(乙烯):酸性KMnO4溶液,洗气;⑤乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯;⑥淀粉溶液(葡萄糖):渗析;⑦提取溶解在水中的少量碘:加入CCl4,分液,取出有机层再分离
A.①②④⑤ B.②③④⑤ C.②④⑤ D.④⑤⑥⑦
例18-3.在有B离子存在的情况下,欲用试剂C来检验溶液中是含有A离子。下表所加试剂C能够对A离子进行成功检验的是( AD)
(说明:在实验过程中不允许加热、过滤等操作。)
|
先 项 |
试剂C |
A离子 |
B离子 |
|
A |
HCl、BaCl2 |
SO42- |
SO32- |
|
B |
AgNO3 |
Cl- |
I- |
|
C |
KSCN |
Fe2+ |
Fe3+ |
|
D |
NH3·H2O |
Al3+ |
Ag+ |
考点19.掌握化学实验的记录方法和运用化学知识设计一些基本实验:(1)根据实验现象,观察、记录、分析或处理数据,得出正确结论。(2)根据实验试题要求,设计或评价实验方案。(3)能绘制和识别典型的实验仪器装置图。以上各部分知识与技能的综合应用。
例19-1.某化学兴趣小组对硫酸铜晶体里结晶水的含量进行实验探究。实验步骤为:
①取晶体研磨;②用托盘天平称量25.0 g硫酸铜晶体试样;③加热、冷却;④称量;⑤再加热、冷却和称量;⑥多次测定不同温度下坩埚中固体的质量;⑦当硫酸铜晶体全部变成白色粉末后,继续对白色粉末进行加热,结果又观察到白色粉末慢慢发生颜色变化,所测定固体质量随温度的升高而变化的曲线如下图。⑧对实验数据进行分析处理。
请回答下列问题:
(1)步骤①需要的实验仪器是____________________。
(2)步骤③具体的操作是:将盛有硫酸铜晶体的坩埚用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体。加热一段时间后,若晶体显蓝色,此时应当________________________________,然后将坩埚放在______________里冷却。
(3)步骤⑤具体的操作是重复③④的操作,直到__________________________。
(4)30℃-110℃间所得固体的化学式是_____________________,1000℃以后所得固体的化学式是______________________。
(5)通过实验探究可知,进行硫酸铜晶体中结晶水含量测定实验时,温度应控制在_________________范围内。
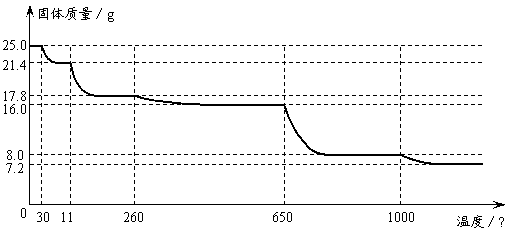 答案:(1)研钵;(2)继续加热,直到晶体完全变成白色粉末,且不再有水蒸气逸出,干燥器;(3)连续两次称量的质量差不超过0.1g为止;(4)CuSO4·3H2O
、Cu2O;
答案:(1)研钵;(2)继续加热,直到晶体完全变成白色粉末,且不再有水蒸气逸出,干燥器;(3)连续两次称量的质量差不超过0.1g为止;(4)CuSO4·3H2O
、Cu2O;
(5)260℃-650℃
 例19-2.利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等。
例19-2.利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等。
考点10.IA和ⅡA族元素¬--典型的金属
(1)了解金属钠的物理性质,掌握钠和镁化学性质。(2)从原子的核外电子排布,理解IA、ⅡA族元素(单质、化合物)的相似性和递变性。(3)以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
例10.下列说法正确的是( D )
①食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理相同;②固体氢氧化钠存放在带橡皮塞的广口瓶中主要是防止其潮解;③熔点:钾>钠>钠和钾的合金;④向紫色石蕊试液中加入过量的Na2O2粉末,振荡后溶液呈蓝色;⑤溴乙烷中加入NaOH溶液加热,能生成乙烯;⑥向含有Na+、SO32-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,Na+和CO32-的物质的量不变
A.①②③④⑤⑥ B.②③④⑤⑥ C.①③④⑤ D.全部错误
考点11.卤族元素--典型的非金属
(1)以氯为例,了解卤族元素的物理性质和化学性质。(2)从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。(3)掌握氯气的化学性质,了解几种重要的含卤素化合物的性质和用途。
例11-1.下列说法中正确的是( D )
①将SO2和Cl2分别通入石蕊试液后,石蕊试液都是先变红后褪色;②向溴水和碘水中分别加入少量CCl4后,下层的颜色都比上层深;③液溴保存在盛有水的棕色玻璃瓶中,用橡胶塞;④铜丝在氯气中燃烧时产生棕黄色的烟;⑤随着核电荷数的递增,卤族元素单质的沸点逐渐升高、气态氢化物稳定性逐渐减弱;⑥实验室用含4molHCl的浓盐酸与足量的MnO2充分反应,可制得1 mol氯气
A.①②③④⑤⑥ B.①②③④⑤ C.①②④⑤ D.②④⑤
例11-2.A、B、C、D、E、F、G、H、I、J、K、L是中学里常遇到的一些物质,它们之间有如下的转化关系,有些必要的信息已在图框中注明。回答下列问题:
(1)H的电子式为_______________ _______。
(2)在实验室中收集气体B的方法是____________ ___ ;在实验室中制取气体C的化学反应方程式是 。
(3)写出下列各方程式:
C+F→H+L化学反应方程式:________________ ;
I+E→K的离子反应方程式: 。
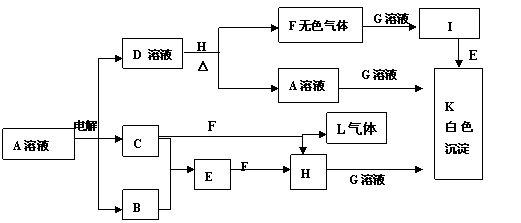
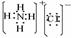 答案:⑴
答案:⑴
⑵向下排空气法、 4HCl(浓)+MnO
|
⑶3Cl2+8NH3=N2+6NH4Cl、Ag(NH3)2++ OH-+3H+ +Cl-=AgCl↓+2NH4++H2O
考点12.其他常见的非金属元素(如:H、O、S、N、P、C、Si)
(1)了解这些元素的单质及某些氧化物、氢化物的性质。除水、氨、甲烷外,只要求根据递变规律了解其他非金属元素的简单气态氢化物的性质。(2)以Na2O2为例,了解过氧化物的性质。(3)掌握硫酸、硝酸的化学性质。(4)以硫酸为例,了解化工生产化学反应原理的确定。初步了解原料与能源的合理利用、“三废处理”与环境保护以及生产过程中的综合经济效益问题。(5)了解常见盐类的性质和用途。(6)初步了解常见化肥的基本性质。(7)了解硫、氮、碳的氧化物对大气的污染及其防治。(8)初步了解氟氯烃、含磷洗涤剂及粉尘对环境及人类健康的影响。(9)初步了解生活用水的净化及污水处理的基本原理。
例12-1.下列各项操作中,不发生“先沉淀后溶解”现象的是( A )
①向NaAlO2溶液中通入过量的CO2 ;②向Fe(OH)3胶体中逐滴加入过量的稀硫酸;③向饱和Na2CO3液中通入过量的CO2;④向漂白粉溶液中通入过量的CO2;⑤向硫酸氢钠溶液中逐滴加入过量的氢氧化钡
A. ①③⑤ B.②③⑤ C.①②③⑤ D.①②③
例12-2.由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。这类材料中研究较多的是化合物G。
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。请推断:G 和E
的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式 。
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________。
答案:(1)Si3N4、SiCl4;(2)Si3N4+3O2=3SiO2+2N2 ;(3)+4、-3、原子晶体
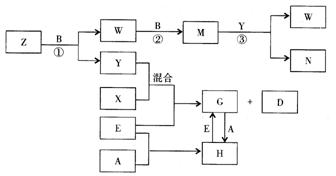 例12-3.A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
例12-3.A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
回答下列问题:
(1)A的化学式为 。
(2)写出反应③的化学反应方程式 。
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为 。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×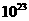 ,则参加反应的E的质量为 g。
,则参加反应的E的质量为 g。
(5)将Z与N反应后的产物溶于水中,则常温该溶液的pH 7,其原因是(用离子方程式表示) 。
答案:(1)Cl2;(2)3NO2+H2O=2HNO3+NO;(3)4NH3+6NO=5N2+6H2O;(4)14;(5)<,NH4++H2O NH3·H2O+H+。
NH3·H2O+H+。
考点13.其他常见的金属(如:Fe、Al)
(1)了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。(2)掌握Fe和Al的化学性质。(3)了解常见金属的活动顺序。(4)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性。(5)了解铝的重要化合物。(6)初步了解合金的概念。
例13-1.生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、嗅和味等。目前城市自来水处理过程中所使用的主要试剂仍是Cl2(消毒剂)和Al2(SO4)3(沉降剂),但由于种种原因,用这两种物质处理水质,总有缺陷。有资料报道:NaFeO4是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+,因此使用该物质可代替Cl2和Al2(SO4)3。
(1)配平工业制备铁酸钠的化学方程式:
Fe2O3+ NaNO3+ NaOH-- Na2FeO4+ NaNO2+ H2O
(2)以上反应中,氧化剂为 (填编号)。
a.Fe2O3 b.NaNO3 c.NaOH d.Na2FeO4
(3)当反应物中含有1.4mol Na+,且上述反应恰好完全进行时,电子转移总数为 NA。
(4)据上海一具有一流生产工艺的自来水厂的科研人员介绍,目前仍不宜推广使用Na2FeO4,你认为其可能的主要原因是 (填编号)。
a.Na2FeO4是强氧化剂,作为消毒剂不合格
b.Na2FeO4被还原为Fe3+,Fe3+水解要形成胶体
c.Na2FeO4被还原为Fe3+,Fe3+在水中呈黄色,影响水质的色度
d.Na2FeO4被还原为Fe3+,Fe3+水解呈酸性,使pH略降低
 (5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+
2Fe(OH)3 + 4KOH。则该电池的负极反应为
。
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+
2Fe(OH)3 + 4KOH。则该电池的负极反应为
。
答案:(1)1,3,4,2,3,2;(2)b;(3)1.2;(4)c ;(5)Zn-2e- +2OH-= Zn(OH)2
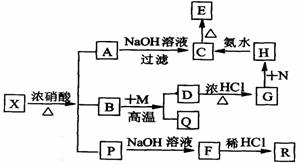 例13-2.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质
量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。试填空: (1)X的化学式为 。
例13-2.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质
量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。试填空: (1)X的化学式为 。
(2)N最好选择下列物质中的
(填序号) a.KMnO4 b.HNO3 c.H2O2 d.C12
(3)写出反应的离子方程式:
D+G ;
H+C 。
(4)B+M反应的化学方程式: 。
答案:(1)Fe3C;(2)cd; (3)Fe3O4十8H+==Fe2++2Fe3++4H2O
;Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+;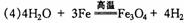
例13-3.工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
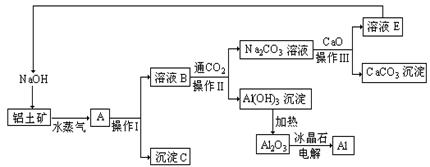
请回答下列问题:
(1)沉淀C的化学式为 ,该物质除了用于金属冶炼以外,还可用作 。
(2)操作I、操作II、操作III都是 (填操作名称),实验室要洗涤Al(OH)3沉淀,所需要的玻璃仪器有 。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有 (填化学式)。用此法制取铝的副产品是 (填化学式)。
(4)写出Na2CO3溶液与CaO反应离子方程式: 。
(5)经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。
|
|
Al2O3 |
Fe2O3 |
Na2O(由NaOH折算成Na2O) |
|
铝土矿 |
55% |
16% |
0% |
|
赤泥 |
15% |
48% |
8% |
则生产中每消耗1t铝土矿将产生 吨赤泥,每炼1t铝,理论上需要 吨铝土矿,应补充 吨NaOH。
答案:(1)Fe2O3、颜料;(2)过滤,烧杯、漏斗、玻璃棒;(3)CaO和CO2,Fe2O3和O2;(4)CO32-+CaO+H2O=CaCO3+2OH-;(5)1/3、3.78、0.129
考点14.无机化学综合应用
 (1)了解在生活和生产中常见的无机化合物的性质和用途。(2)以上各部分知识的综合应用。
(1)了解在生活和生产中常见的无机化合物的性质和用途。(2)以上各部分知识的综合应用。
例14-1.钛(Ti)是一种性能非常优越的金属,因其含量丰富、密度小、硬度大、熔点高、耐腐蚀而广泛运用于潜水艇、导弹、人造卫星和宇宙飞船等领域。因此有人说,21世纪钛将成为铁和铝之后的第三金属。
(1)钛在化合物中的化合价主要有+2、+3、+4,其中以+4价钛的化合物最稳定。 钛在自然界的主要矿物有是钛铁矿(FeTiO3)和金红石。金红石的主要成分是钛的氧化物,该氧化物的晶体结构模型如右图所示,该钛的氧化物的化学式为 。
(2) TiCl4常温下为无色液体(熔点-23.2℃,沸点136.4℃),易挥发,有刺激气味,易溶于有机溶剂。钛铁矿提炼钛目前通常采用氯化法,即将钛铁矿与焦炭混合,通入氯气并加热(1173K)先制得TiCl4,再将TiCl4蒸馏出来提纯后,在氩气的保护下与镁共热(1220-1420K)制得钛。
① 请配平氯化法制得TiCl4的化学方程式:
FeTiO3 + Cl2+ C 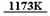 TiCl4 + FeCl3(s) + CO(g)
TiCl4 + FeCl3(s) + CO(g)
②写出其
写出TiCl4与镁共热制得钛的化学方程式: 。
③TiCl4在潮湿的空气中很容易形成烟雾,写出其
化学反应的方程式 。
④TiCl4是_______化合物(填写:“离子”或“共价”),理由是:____________________
_________________________________________________。
答案
:⑴TiO2 ;⑵
① 2、7、6、2、2、6 ;② TiCl4 +2Mg 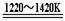 Ti + 2MgCl2;③
TiCl4+3H2O =
H2TiO3+4HCl;④
Ti + 2MgCl2;③
TiCl4+3H2O =
H2TiO3+4HCl;④
共价,由TiCl4它在常温下为无色液体(熔点- 23.2℃,沸点136.4℃),易挥发,有刺激气味,易溶于有机溶剂等性质,可以确定TiCl4是共价化合物。
例14-2.铬是1797年法国化学家沃克兰在分析铬铅矿时首先发现的,位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中其中+3较为稳定。某化学兴趣小组对铬的化合物进行探究性研究。
(1)Cr2O3微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其电离方程式是 。
(2)六价的铬有剧毒,工业上处理含铬废水的常见方法是“铁氧磁体法”,即把FeSO4·7H2O加入含铬(化合价为VI,以下罗马字母均表示元素的价态)废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III)。调节溶液pH达8-10,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)全部析出组成相当于FeⅡ[FexⅢ·Cr2-xⅢ]O4(磁性材料铁氧体的组成)沉淀。
①若废水中的Cr(Ⅵ)以Cr2O72-表示,试写出在pH<4时,Fe2+还原Cr2O72-的离子反应方程式 。
②确定铁氧磁体中X的值为 。
③根据所得X的值计算,若要除去废水中的Cr(Ⅵ) [Cr(Ⅵ)按CrO3计算],且使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)全部析出组成铁氧体沉淀,则加入的FeSO4·7H2O与CrO3的质量比应为[m(FeSO4·7H2O)/m(CrO3)] 。
④工业上通常还采用“电解法”处理:向工业废水中(主要含Cr2O72-)加入适量的NaCl,进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,使废水中的铬含量达排放标准。则在装置中应该用 (填材料名称)做电解池的阳极,阴极上电极反应方程式是 。
答案:(1)Cr3++3OH- 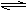 Cr(OH)3
Cr(OH)3 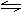 H++CrO2-+
H2O;(2)① Cr2O72-+6 Fe2++14 H+ = 6 Fe3++2
Cr3++7 H2O ;②1.5 ; ③13.9;④铁 、 2H+-2e-=H2↑。
H++CrO2-+
H2O;(2)① Cr2O72-+6 Fe2++14 H+ = 6 Fe3++2
Cr3++7 H2O ;②1.5 ; ③13.9;④铁 、 2H+-2e-=H2↑。
7.元素周期律和周期表
(1)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。(2)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以IA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
例7-1.下列各选项所述的两个量,前者一定大于后者的是( D )
①HF和HBr的沸点;②纯水在25℃和80℃时的pH;③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量;④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数;⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数;⑥耐火材料MgO和CaO的熔点;⑦H-和H+离子半径;⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②④⑥ B.①②③⑤ C.⑤⑥⑦⑧ D.①②⑥⑦
例7-2.下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
|
|
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑤ |
⑥ |
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
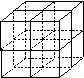 (1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(2)元素③氢化物的电子式为 ,其空间构型为 。
(3)元素④的氢化物沸点比元素⑤的氢化物沸点 (填“高”或“低”)。
(4)元素①和元素⑥形成的化合物是 晶体(填晶体类型),右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素①和元素⑥所在位置。
(5)元素①②形成的合金通常情况下呈 态,可作为 。
 答案:(1)略;(2)
答案:(1)略;(2)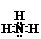 ,三角锥形;(3)高;
,三角锥形;(3)高;
(4)离子晶体,结构图;
(5)液态,原子反应堆的导热剂
20.一定条件下将质量为Xg的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Yg,下列对应关系一定不正确的是
|
序号 |
有机物 |
X |
Y |
|
A |
C2H4和C3H6的混合物 |
m |
15m/7 |
|
B |
HCOOH |
m |
m |
|
C |
CH3OH
和CH3COOH的混合物 |
m |
m |
|
D |
CH3COOCH3 |
m |
45m/37 |
19.含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.NaOH和Na2S B.Na2S和NaHS C.NaHS D.Na2S
 H++A2-;则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
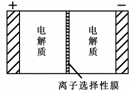
H++A2-;则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A) Na2S4+3NaBr,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是
Na2S4+3NaBr,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是 ( BD
)
( BD
) A.充电过程中,Na+
离子的流向为从右到左
A.充电过程中,Na+
离子的流向为从右到左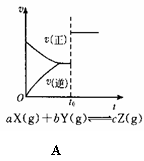
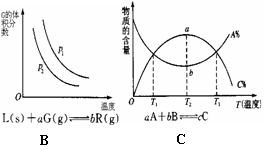
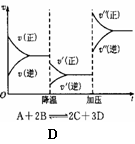
 A.②④⑥ B.③④⑥ C.①④⑥ D.①③⑥
A.②④⑥ B.③④⑥ C.①④⑥ D.①③⑥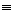 N放出942kJ热量。根据以上信息和数据,下列说法正确的是( BC )
N放出942kJ热量。根据以上信息和数据,下列说法正确的是( BC )
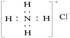 D.氟原子结构示意图:
D.氟原子结构示意图: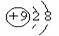
 Na++H++SO42-;
Na++H++SO42-;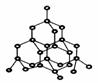 例3-1.用NA表示阿伏加德罗常数,下列说法正确的是(
B )
例3-1.用NA表示阿伏加德罗常数,下列说法正确的是(
B )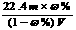 B.物质的量浓度C可表示为:
B.物质的量浓度C可表示为: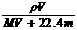
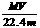 D.溶液密度ρ可表示为:
D.溶液密度ρ可表示为: