网址:http://m.1010jiajiao.com/timu3_id_434105[举报]
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
|
0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X 溶液 |
0.1 mol·Lˉ1 双氧水 |
1 mol·Lˉ1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。

(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s) 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
查看习题详情和答案>>
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ =2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2 才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ = 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
|
0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X 溶液 |
0.1mol·Lˉ1 双氧水 |
1 mol·L1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ = 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s) 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。
查看习题详情和答案>>
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 双氧水 | 1 mol·L1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。 查看习题详情和答案>>
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1 mol·Lˉ1 双氧水 | 1 mol·Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。
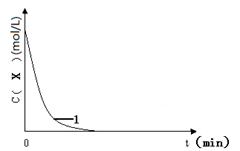
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
查看习题详情和答案>>
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
查看习题详情和答案>>
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1 mol·Lˉ1 双氧水 | 1 mol·Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。

(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。