网址:http://m.1010jiajiao.com/timu3_id_434026[举报]
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、(1)合成二甲醚反应一:![]()
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是________.
A、低温高压
B、加催化剂
C、体积不变充入N2
D、增加CO浓度
E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)![]() CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:
CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:

该反应是________(填“放热”或“吸热”)反应,原因是________(从平衡常数角度说明).
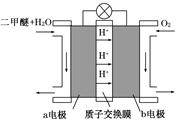
Ⅱ、二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为________.
电池在放电过程中,b对应的电极周凰溶液的pH________.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1 L 0.1 mol/L KCl溶液,写出电解总反应的离子方程式为________.
(3)室温时,按上述(2)电解一段时间后,取25 mL上述电解后溶液,滴加0.2 mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在________区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是________.
请填写下列空白:
(1)相同条件下,二甲醚与乙醇的燃烧热_________________(填“相同”或“不同”),理由是____________________________________________________________________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是_________________________。
(3)制备二甲醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:

①在催化反应室中进行的反应均为可逆反应,增大体系的压强对甲烷转化率的影响是____________(填“增大”“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5y kg(即![]() ×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气___________ m3(标准状况)。
×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气___________ m3(标准状况)。
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是
A.二甲醚分子中只含有极性键 B.二甲醚为不可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为:CH3OCH3 - 12e- + 12OH- = 2CO2 + 8H2O
D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(g);△H = - 1455 kJ/mol
查看习题详情和答案>>
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是
A.二甲醚分子中只含有极性键
B.二甲醚为不可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为:CH3OCH3 - 12e- + 12OH- = 2CO2 + 8H2O
D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(g);△H = - 1455 kJ/mol
查看习题详情和答案>>
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下: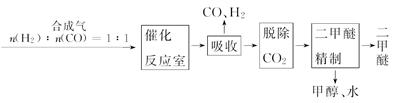
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) 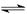 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g) 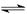 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) 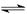 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g) 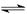 CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) 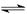 CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是 极。