网址:http://m.1010jiajiao.com/timu3_id_433928[举报]

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在元素周期表中位置________。
(2)写出C、H物质的化学式:C______________________,H_____________________。
(3)写出反应①⑦的化学方程式:
反应①:____________________________________________________________。
反应⑦:_____________________________________________________________。
(4)反应⑥过程中的现象是____________________________________________________。
查看习题详情和答案>>A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中位置
(2)写出C、H物质的化学式:C ; H
(3)写出反应①、⑥的化学方程式和③、⑦的离子方程式:
反应①:________________________________
反应⑥:________________________________
反应③:________________________________
反应⑦:________________________________
(4)反应⑥过程中的现象是 。
A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。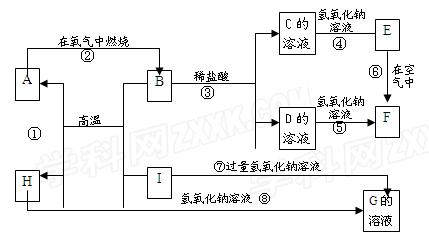
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中位置
(2)写出C、H物质的化学式:C ; H
(3)写出反应①、⑥的化学方程式和③、⑦的离子方程式:
反应①:
反应⑥:
反应③:
反应⑦:
(4)反应⑥过程中的现象是 。
(8分) A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。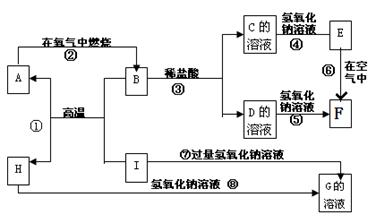
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中位置
(2)写出C、H物质的化学式:C ; H [来源:学科网ZXXK]
(3)写出反应①、⑥的化学方程式和③、⑦的离子方程式:
反应①:________________________________
反应⑥:________________________________
反应③:_______________ _________________
_________________
反应⑦:________________________________
(4)反应⑥过程中的现象是 。
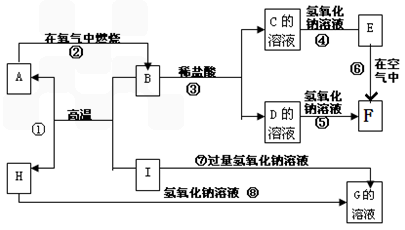
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中位置__________
(2)写出C、H物质的化学式:C______;H_______
(3)写出反应①、⑥的化学方程式和③、⑦的离子方程式:
反应①:________________________________
反应⑥:________________________________
反应③:________________________________
反应⑦:________________________________
(4)反应⑥过程中的现象是_____________。