29.(8分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可作氧化剂,应用领域十分广泛。
实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
|


 铬铁矿等原料
Na2CrO4溶液
铬铁矿等原料
Na2CrO4溶液

|



铬渣(含硫酸钠)
回答下列问题:
⑴步骤I中反应化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2在常温下该反应速率极慢,下列措施中能使反应速率增大的是 。(填字母)
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
⑵步骤III需将溶液的pH调至7~8,并煮沸,其目的是 。
⑶步骤IV中发生反应的离子方程式为 。
⑷利用下面的复分解反应,将红矾钠与KCl固体按1:2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl (已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)。基本实验步骤为:①溶解;② ;③ ;④冷却、结晶,再过滤得K2Cr2O7晶体。其中③应在 (填“高温”或“低温”)条件下进行。
[答案](8分)
⑴A、C(2分) ⑵除去AlO2-杂质(1分)
⑶2CrO42-+2H+==Cr2O72-+H2O(2分)
⑷②蒸发(1分) ③过滤(1分) 高温(1分)
[解析]⑴将原料粉碎,即增大反应物的接触面积,可加快反应速率,由于纯碱是固体,固体用量的多少不影响化学反应速率,升高温度可加快反应速率。⑵由于题中明确铬铁矿中含有少量铝的氧化物,故后续操作必须除去铝,要注意的是本题不能回答除铁,原因是步骤I中反应已生成Fe2O3。⑶利用步骤V的反应可反推步骤IV中生成物是Na2Cr2O7,由此可知酸化时发生了CrO42-离子的缩合反应。⑷由于④进行冷却结晶,故③必为趁热过滤。
[考点]化学实验--化学生产中流程图分析
选考题(选择30、31题其中一道作答,请在答题纸上标明所选题号)
27.(9分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶。请回答下列问题:
⑴上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去。
⑵①中加入的试剂应该选择___________________________为宜。
⑶②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
⑷下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
[答案](9分)⑴氢氧化铁(1分) ⑵氨水(1分)
⑶2Fe3++3Mg(OH)2 == 3 Mg2+ +2Fe(OH)3 (3分)
⑷A C D E(4分)
[解析]①中为了不引入杂质离子,应加入氨水使Fe3+沉淀,而不能用NaOH溶液。②中根据溶解度表可明确Mg(OH)2能较容易转化为Fe(OH)3,因此在MgCl2溶液中加入足量Mg(OH)2可除去Fe3+,然后将沉淀一并过滤。③中利用高价阳离子Fe3+极易水解的特点,据题意可知调节溶液的pH=4可使Fe3+沉淀完全,为了不引入杂质离子,因此可使用CuO、Cu(OH)2、CuCO3等调节溶液的pH。
[考点]电解质溶解--沉淀溶解平衡
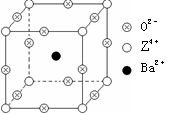 (15分)已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
(15分)已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
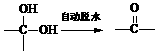
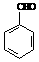
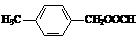 、
、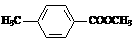 、
、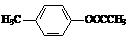 、
、
 (8分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(8分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
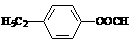
 (10分)A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)
(10分)A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)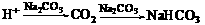 的A有三种:
的A有三种: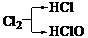 、
、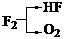 、
、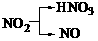 ,考虑到E为弱酸,则A应是F2。
,考虑到E为弱酸,则A应是F2。 AlO2-
AlO2-  CO+H2
CO+H2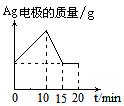 B.
B.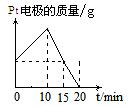
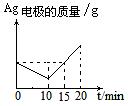 D.
D.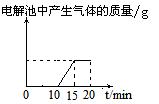
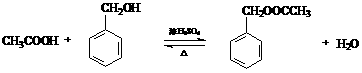
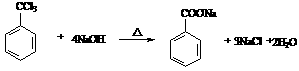
 有一反应:2A+B
有一反应:2A+B