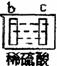
26、我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。
他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水
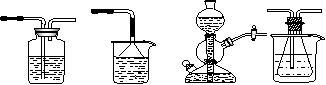
A B C D
四种盐在不同温度下的溶解度(g/100g水)表

|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
||||
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
||||
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
||||
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
||||
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
⑴装置的连接顺序应是_______________(填字母);
⑵A装置中盛放的试剂是_______________,其作用是_____________________;
⑶在实验过程中,需要控制D温度在30℃-35℃,原因是____________________________
,
为了便于控制此温度范围,采取的加热方法为___________;
⑷将锥形瓶中的产物过滤后,所得的母液中含有_____________________(以化学式表示),可加入氯化钠,并进行_______操作,使NaCl溶液循环使用,同时可回收NH4Cl。
⑸测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32―+H+→HCO3―反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_____________________。
21、下列有关实验处理方法正确的是……………………………………………( )
A、实验室常采用浓硫酸使甲酸脱水的方法制备一氧化碳气体
B、实验室制备乙酸乙酯时,为了提纯乙酸乙酯常用水和氢氧化钠溶液洗涤
C、在苯酚钠的水溶液中通入过量的二氧化碳气体后进行过滤获得苯酚
D、有少量硫酸亚铁溶液的试管中逐滴加入氢氧化钠溶液,边滴加边振荡制备氢氧化亚铁
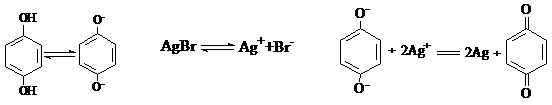
|
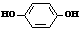
A、在显影过程中 是氧化剂
B、溶于显影液的O2能加快显影速度
C、在显影液中加入一定量Na2CO3,可加快显影速度
D、曝光时产生的微量Ag在显影时起了催化作用
第Ⅱ卷(共84分)
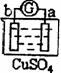
17、有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
实验装置 |
部分实验现象 |
|
|
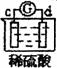
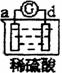
由此可判断这四种金属的活动性顺序是……………………………………………………( )
A、a>b>c>d B、b>c>d>a C、d>a>b>c D、a>b>d>c
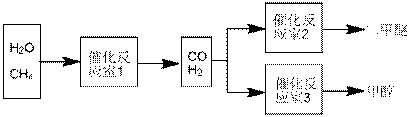
 CO(g)+3H2(g)+Q, Q<0。
CO(g)+3H2(g)+Q, Q<0。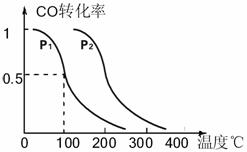 在其它条件不变的情况下降低温度,逆反应速率将_______
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。
在其它条件不变的情况下降低温度,逆反应速率将_______
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。 CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
 H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是…( )
H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是…( )