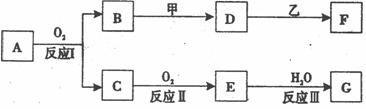
0 42918 42926 42932 42936 42942 42944 42948 42954 42956 42962 42968 42972 42974 42978 42984 42986 42992 42996 42998 43002 43004 43008 43010 43012 43013 43014 43016 43017 43018 43020 43022 43026 43028 43032 43034 43038 43044 43046 43052 43056 43058 43062 43068 43074 43076 43082 43086 43088 43094 43098 43104 43112 447348
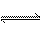 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。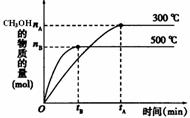
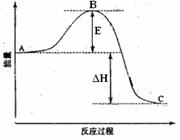
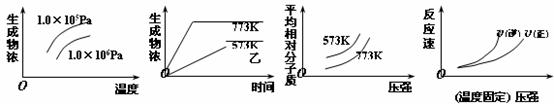
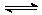 2NH3(g);△H<0
2NH3(g);△H<0