33.(16分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 制水煤气的化学反应方程式为:_____________________________________。
⑵ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)
+ CO(g)  CH3OH(g); ΔH=a kJ·mol-1
CH3OH(g); ΔH=a kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=b kJ
CH3OCH3(g) + H2O(g);ΔH=b kJ ·mol-1
·mol-1
③ CO(g) + H2O(g)
 CO2(g) + H2(g); ΔH=c kJ·mol-1
CO2(g) + H2(g); ΔH=c kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g)
+ CO2 (g)的ΔH= ___________ ;(与abc的函数关系)。若
△H<0,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
CH3OCH3(g)
+ CO2 (g)的ΔH= ___________ ;(与abc的函数关系)。若
△H<0,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
a.高温 b.高压 c.减少CO2的浓度
d.分离出二甲醚 e.增加CO的浓度 f.加入催化剂
⑶ 已知反应②2CH3OH(g)
 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如 下:
下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.64 |
0.5 |
0.5 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经8 min反应达到平衡,此时c(CH3OH) =
_________;该时间内反应速率v(CH3 OH)
= __________。
OH)
= __________。
31.(16分)广州市销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以Ⅰ计) |
20-50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
____KIO3+___KI+____H2SO4===_____K2SO4+____I2+_____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是______________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液; c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2S2O===2I-+S4O。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是________ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____________________mg/kg。
 ]mol
]mol
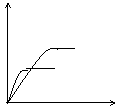
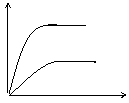
 2C (g) △H<0 。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据做出了下列关系图
2C (g) △H<0 。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据做出了下列关系图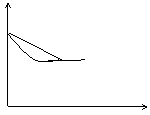
 C的
B的
混合气
C的
B的
混合气