2. 下列有关表述正确的是
2s 2p
|
↑↓ |
|
↑ |
↑ |
↓ |
A. N原子的价电子轨道表示式:
B.碳酸氢钠在水溶液中的电离方程式:NaHCO3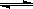 Na++H++CO32-
Na++H++CO32-
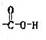 C.羧基的结构式:
C.羧基的结构式:
D. 明矾的化学式为 KAlSO4·12H2O
26. 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
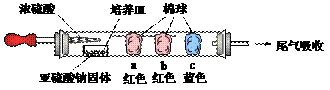
|
棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
|
a |
_______________ |
棉球变白, 微热后又恢复红色 |
解释:_____________________________ 结论:该气体具有漂白性。 |
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
|
c |
_______________ |
棉球变为白色 |
化学方程式: _________________________ 结论:该气体具有_________性。 |
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入
|
溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。 ① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
|
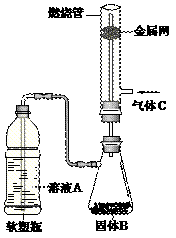 |
② 若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为_________(填化学式)。此火焰温度极高,叫做________,常用于切割焊接金属。
25. 三种不同条件下,分别向容积固定的2L密闭容器中充入2molA和1mol B,发生反应如下:2A (g) +B (g) 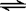 2D (g) + Q,相关条件和数据见下表。
2D (g) + Q,相关条件和数据见下表。
|
|
实验I |
实验II |
实验III |
|
反应温度 / ℃ |
800 |
800 |
850 |
|
达平衡时间 /min |
40 |
10 |
30 |
|
c( D )平衡 /mol·L-1 |
0.5 |
0.5 |
0.15 |
|
反应的能量变化 / kJ |
Q1 |
Q2 |
Q3 |
请回答:
(1)实验III,反应进行到30min时的平均速率v (D)为_________________。
(2)实验II可能隐含的反应条件是________________________________________。
(3)下列描述中能说明上述反应已达平衡的是__________(填序号)。
a. c(A) = 2 c(B) b. 2 v (D)正 = v (B)逆
c. 容器内气体密度不随时间而变化 d. 容器内气体压强不随时间而变化
(4)对比上述实验,可知该反应的反应热Q___0(填“>”或“<”),并将Q、Q1、Q2、Q3按从小到大的顺序排列:_______________________________。
(5)若实验I达到平衡后,保持温度不变,再向密闭容器中通入由1mol A和1mol D组成的混合气体,则平衡将_______________移动(填“正向”、“逆向”或“不”),新平衡状态时c(D)为____________mol·L-1。
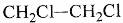
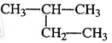
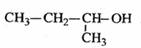 下列有机物命名正确的是
下列有机物命名正确的是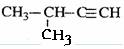
 2O3。
2O3。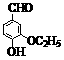 )是食品添加剂的增香原料。
)是食品添加剂的增香原料。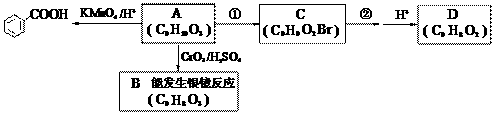
 RCHO;
RCHO;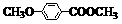 )是一种医药中间体。由茴香醛(
)是一种医药中间体。由茴香醛(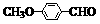 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。 (4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示:
(4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示: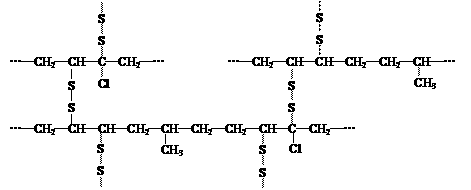
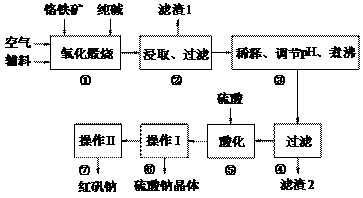
 8Na2CrO4 + 2Fe2O3
+ 8CO2
8Na2CrO4 + 2Fe2O3
+ 8CO2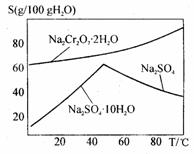 (2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。
(2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。