17.(14分)现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠
④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_ 。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___ ___。
 (3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 _____。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 _____。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b= 。
(5)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=__ __(填数据);②若x+y=13,则a/b=__ __
(填数据);
③若x+y>14,则a/b=__ __(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH x和y的关系式 (填表达式)。
|
|
Q |
R |
|
|
T |
|
|
W |
18 (12分)Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____. (4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式______. (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________. (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =________kJ/mol(注:题中所设单质均为最稳定单质)
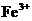 溶液中:
溶液中: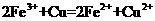
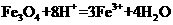
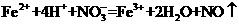
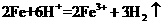
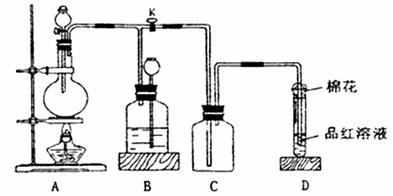
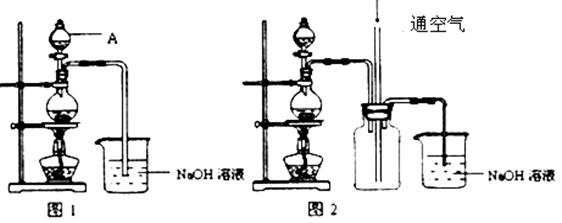
 X(g)+Y(g)
X(g)+Y(g)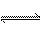 2Z(g)+W(g);△H<0。
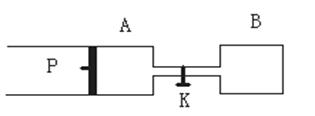
2Z(g)+W(g);△H<0。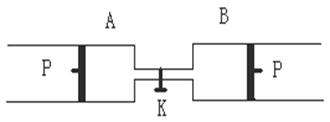 (2)如果将B端改装成与A端一致(如右图),
(2)如果将B端改装成与A端一致(如右图),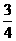 倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
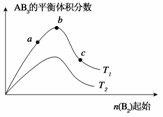
 2AB3(g)化学平衡状态的影响时,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论正确的是
( )
2AB3(g)化学平衡状态的影响时,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论正确的是
( )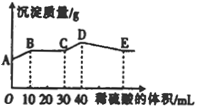 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的( )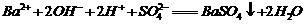
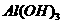 、
、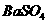
 D.E点表示的溶液呈中性
D.E点表示的溶液呈中性