27、(15分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
 (1)已知:H-H键能为436
kJ/mol, N N键能为945
kJ/mol,N-H键能为391
kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(1)已知:H-H键能为436
kJ/mol, N N键能为945
kJ/mol,N-H键能为391
kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对
NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。
18、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)  Z(g)+W(s) △H>0下列叙述正确的是( )
Z(g)+W(s) △H>0下列叙述正确的是( )
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
|
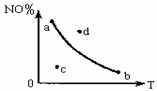
 2NO2(g) △H<0中NO2的百分含量NO2%与T变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是 ( )
2NO2(g) △H<0中NO2的百分含量NO2%与T变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是 ( )
 A. a B.
b
A. a B.
b 
 pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )[来
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )[来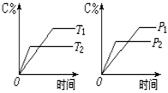 A.到达平衡后,若使用催化剂,C的质量分数增大
A.到达平衡后,若使用催化剂,C的质量分数增大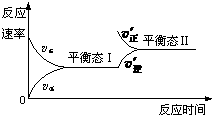 A.反应达平衡时,正反应速率和逆反应速率相等
A.反应达平衡时,正反应速率和逆反应速率相等