4.下列离子方程式的正误判断及评价均正确的是
|
|
离子反应 |
离子方程式 |
判断及评价 |
|
A |
在NH4HCO3溶液中加少量NaOH加热 |
NH4++OH- =NH3·H2O |
错误,加热条件下应生成氨气 |
|
B |
在FeI2溶液中加少量的溴水 |
2I-+Br2=I2+2Br- |
正确,还原性I-大于Fe2+ |
|
C |
在NaAlO2溶液中通入少量的CO2气体 |
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
错误,应生成HCO3- |
|
D |
在稀硝酸中加入少量的铁粉 |
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
正确,稀硝酸的还原产物为NO |
31.化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
|
实验序号 |
KClO3质量/g |
MnO2质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
表二 用A作催化剂
|
实验序号 |
KClO3质量/g |
A的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH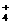 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH-)下降,说明氨水的电离平衡向 移动。
29.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+≒2Fe2++I2(水溶液)
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移
动(选填:向右、向左、不)。
(2)上述反应的正向反应速度和I-Fe3+的浓度关系为:υ=κC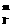 C
C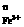 (κ为常数)
(κ为常数)
|
|
C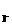 (mol/L) (mol/L) |
C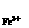 mol/L. mol/L. |
mol/L·s. |
|
(1) |
0.20 |
0.80 |
0.032κ |
|
(2) |
0.60 |
0.40 |
0.144κ |
|
(3) |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算得知:在υ=κC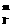 C
C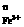 中。M、n的值为 [选填(A)、
中。M、n的值为 [选填(A)、
(B)、(C)、(D)]
(A)m=1,n=1 (B)m=1,n=2 (C)m=2,n=1 (D)m=2,n=2
I-浓度对充应速度的影响 Fe3+浓度对反应速度的影响。(选填:小于、大于、等于)
28.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变
2NO2(g)体系中,n(NO)随时间的变
化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: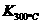 >
>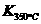 ,则该反应是
热反应。
,则该反应是
热反应。
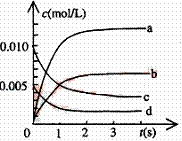 (2)右图中表示NO2的变化的曲线是 。
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v=
。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方
向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 2010年下学期南马高中期中考试试卷
2010年下学期南马高中期中考试试卷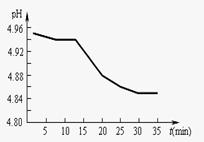 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨 乙+丙 b.乙
乙+丙 b.乙 丙。
丙。