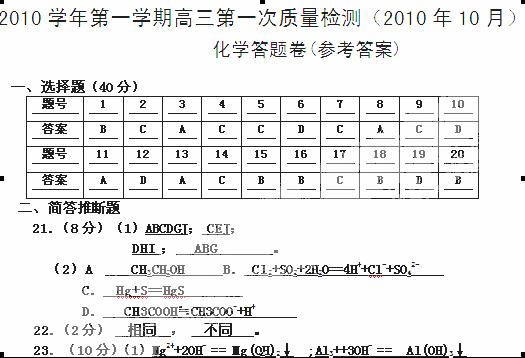
25. (8分)(1) Fe , 四 周期, Ⅷ 族。
(2)C FeCl2 ,H Al2O3 。
|
(3)反应①: 2 Al +Fe2O3 2 Fe +Al2O3 。
反应⑦: 2Al+2NaOH+2H2O==2NaAlO2+3H2 ↑
(4) 白色沉淀迅速变成灰绿色,最后变成红褐色。
27. (9)探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,该班同学进行了以下两个实验:
(9)探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,该班同学进行了以下两个实验:
(1)提出问题实验一的CO2能灭火,实验二的CO2为何能“点火”?
(2)假设与猜想
①Na2O2与CO2发生了反应,可能有Na2CO3生成;
②棉花燃烧,说明该反应放热,使温度达到了棉花的着火点;
③剧烈燃烧,反应中可能有 生成。
(3)设计并进行实验,观察、解释和结论
请你帮助他们完成下表:
|
实验步骤 |
实验现象 |
原因和结论 |
||
|
Ⅰ |
用小矿泉水瓶收集满CO2,再向瓶中加入不同量浅黄色的Na2O2;振荡后将燃着的木条伸向瓶中 |
第①小组放入少量的Na2O2 |
木条未复燃,固体由浅黄色全部变为白色 |
CO2过量(或Na2O2不足),瓶中O2少CO2多,Na2O2全部发生了反应 |
|
第②小组放入的Na2O2稍多一些 |
木条复燃,部分固体变为白色 |
|
||
|
Ⅱ |
两小组均用手触摸瓶的底部 |
瓶底发热 |
|
|
|
Ⅲ |
两小组都各取少量白色固体于试管中,滴入稀盐酸并塞上带导管的橡胶塞,将产生的气体通入 |
|
|
(4)类比推理
Na2O2与H2O反应后应该有NaOH和O2生成。则向包有Na2O2的棉花上滴两滴水,棉花也应剧烈燃烧;向生成的溶液中滴入酚酞应该变红色。
(5)实验与解释
①向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴两滴水,发现有气泡产生,杯底发热,但棉花没有燃烧,其原因可能是 ;
②向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是 。
(6)联想与启示
根据上述实验及分析,请为Na2O2的说明书写保存注意事项: