网址:http://m.1010jiajiao.com/timu3_id_425327[举报]
①在天平上称量一定量的Na2CO3,放入烧杯,加水溶解;
②把制得的溶液小心地注入500mL容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀.填写下列空白:
(1)称量Na2CO3的质量是
(2)操作步骤的正确顺序是(填序号)
(3)本实验使用到的玻璃仪器是
(4)若没有进行④操作,会使结果(填偏高、偏低、无影响,下同)
若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将
若定容时仰视刻度,则所配制的溶液浓度将
(5)在进行②操作时,不慎有液体溅出,应该怎样处理?
(一)实验室用Na2CO3·10H2O配制500ml 0.10 mol·L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
应量取Na2CO3·10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
|
|
|
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ;
A.用适量水洗涤烧杯2—3次,洗涤液均注入容量瓶中,振荡。
B.用托盘天平准确称量所需Na2CO3·10H2O的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(需要时可加热)。
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(二)喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:
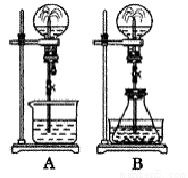
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )。
A.HCl和H2O B.Cl2和NaOH溶液
C.HCl和汽油 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷 泉的是( )
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是( )。
A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是_______上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述________(填图A或图B)装置的原理相似。
查看习题详情和答案>>
某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”),
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装:醋酸含量约为6g/100mL,换算成物质的浓度约为 mol·L-1,滴定前要先将白醋稀释10倍。稀释白醋时需要的仪器有100mL容量瓶、烧杯、玻璃棒、 胶头滴管、 。
(4)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加入30mL蒸馏水,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。
(5)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为20.00mL,NaOH标准液浓度为c mo1/L,三次实 验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 25.02 | 24.22 | 24.18 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度: 。 查看习题详情和答案>>
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”),
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装:醋酸含量约为6g/100mL,换算成物质的浓度约为 mol·L-1,滴定前要先将白醋稀释10倍。稀释白醋时需要的仪器有100mL容量瓶、烧杯、玻璃棒、 胶头滴管、 。
(4)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加入30mL蒸馏水,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。
(5)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为20.00mL,NaOH标准液浓度为c mo1/L,三次实 验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 25.02 | 24.22 | 24.18 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度: 。
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
(1)步骤①中中还需补充的仪器有
(2)步骤③中你选择的酸碱指示剂是
(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是
(4)样品总酸量=