0 42432 42440 42446 42450 42456 42458 42462 42468 42470 42476 42482 42486 42488 42492 42498 42500 42506 42510 42512 42516 42518 42522 42524 42526 42527 42528 42530 42531 42532 42534 42536 42540 42542 42546 42548 42552 42558 42560 42566 42570 42572 42576 42582 42588 42590 42596 42600 42602 42608 42612 42618 42626 447348
 A.次氯酸的电子式
A.次氯酸的电子式 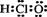 B.二氧化硅的分子式 SiO2
B.二氧化硅的分子式 SiO2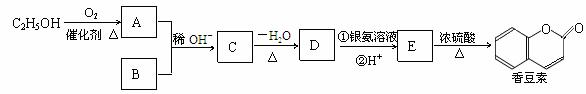
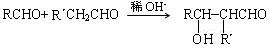 (R、R´为烃基)
(R、R´为烃基)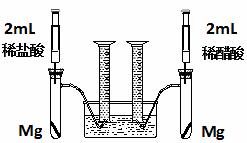 实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。 H++B2-
H++B2- (1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0 。
。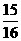 ,则N2的转化率a1=
;
,则N2的转化率a1=
;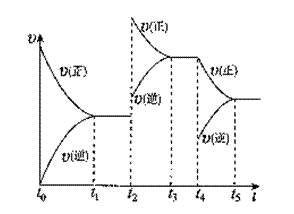 该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
。
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
。 的离子方程式是
。
的离子方程式是
。