摘要:⑴FeSO4, 防止亚铁离子被氧化 , ⑵﹤, ⑶ Al(OH)3+H+==Al3++3H2O,可以
网址:http://m.1010jiajiao.com/timu3_id_425325[举报]
人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质.
(1)医疗上常用
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和
查看习题详情和答案>>
(1)医疗上常用
FeSO4
FeSO4
(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是防止亚铁离子被氧化
防止亚铁离子被氧化
;(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
、HCO3-+H+═H2O+CO2↑
HCO3-+H+═H2O+CO2↑
;(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和
胶体
胶体
,用丁达尔效应
丁达尔效应
可以鉴别(填化学专用名词). 如图是琥珀酸亚铁片的部分说明书,下列关于该药物的说法不正确的是( )
如图是琥珀酸亚铁片的部分说明书,下列关于该药物的说法不正确的是( )| A、与维生素C同服,可增加本品的吸收,是因为维生素C具有还原性 | B、薄膜包衣预混剂作用是防止亚铁盐被空气中的氧气氧化 | C、可用碘水检验该药片中是否含有淀粉 | D、除去该药片的包衣膜后,将药物溶于水溶液为无色 |
(2009?四川)新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下: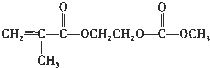
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(4)写出M与足量氢氧化钠溶液反应的化学方程式:
 .
.
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
查看习题详情和答案>>
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
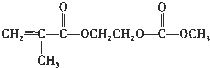
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是
为了防止亚铁化合物被氧化
为了防止亚铁化合物被氧化
.(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有
CO2
CO2
、H2O
H2O
、NH3
NH3
(填化学式)生成.(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
.(4)写出M与足量氢氧化钠溶液反应的化学方程式:


(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
FePO4+Li++e-═LiFePO4
FePO4+Li++e-═LiFePO4
.(2012?江苏三模)草酸合铁酸钾晶体Kx[Fe(C2O4)y]?3H2O可用于摄影和蓝色印刷.实验室制备草酸合铁酸钾晶体的实验流程如下:
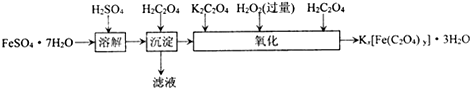
(1)若用铁和稀硫酸制备FeSO?7H2O,常保持
(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
②步骤2中MnSO4溶液的作用是
③在不增加试剂种类的前提下,步骤3的目的是
查看习题详情和答案>>

(1)若用铁和稀硫酸制备FeSO?7H2O,常保持
铁
铁
过量,理由是防止亚铁离子被氧气氧化
防止亚铁离子被氧气氧化
.(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
.(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
2- 4 |

步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
2- 4 |
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
ad
ad
(填序号).②步骤2中MnSO4溶液的作用是
作催化剂
作催化剂
,滴定终点的现象是溶液变为浅红色,且半分钟内部褪色
溶液变为浅红色,且半分钟内部褪色
.③在不增加试剂种类的前提下,步骤3的目的是
测定C2O42-的含量
测定C2O42-的含量
.某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 |
| Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | | Zn+Fe2+=Zn2++Fe |
|
| ③ | 在FeCl3溶液中加入足量铁粉 |
| Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
| ④ |
|
|
| Fe3+具有氧化性 |
实验结论: 。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化 。
查看习题详情和答案>>