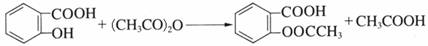
14.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)
+ 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
|
容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
X2 |
Y2 |
XY3 |
||
|
① |
1 |
3 |
0 |
放热 23.15 kJ |
|
② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C.容器②中反应达到平衡时放出的热量为Q
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
非 选 择 题
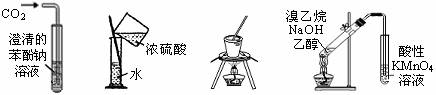
10.下列实验操作与预期实验目的或所得实验结论一致的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
将某气体通入品红溶液中,溶液不褪色 |
该气体中无SO2 |
|
B |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
C |
下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 |
取出分液漏斗中的上层液体 |
|
D |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明该溶液中一定含有Fe2+ |
 常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如
常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如 下列说法正确的是
下列说法正确的是