0 42442 42450 42456 42460 42466 42468 42472 42478 42480 42486 42492 42496 42498 42502 42508 42510 42516 42520 42522 42526 42528 42532 42534 42536 42537 42538 42540 42541 42542 42544 42546 42550 42552 42556 42558 42562 42568 42570 42576 42580 42582 42586 42592 42598 42600 42606 42610 42612 42618 42622 42628 42636 447348
 2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇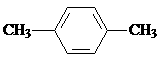 间二甲苯 D.
间二甲苯 D.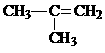 2-甲基-2-丙烯
2-甲基-2-丙烯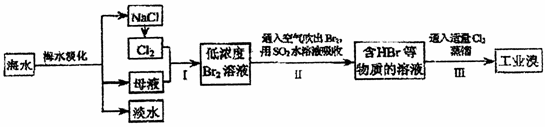
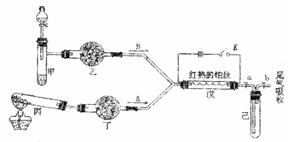
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论: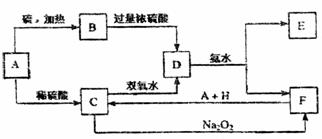
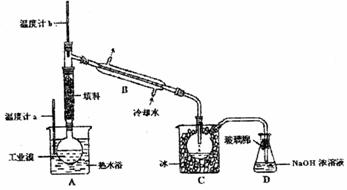
 (10分)某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
(10分)某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。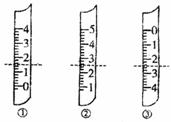 A.①是量简,读数为1.5mL
A.①是量简,读数为1.5mL