20.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
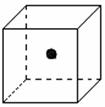 请在立方体的顶点用“●”表示出与之紧邻的硅原子。
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4 (g) + 2H2(g) Si(s) + 4HCl(g)
SiCl4 (g) + 2H2(g) Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
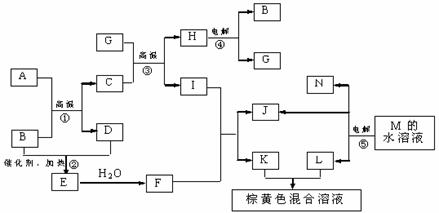 21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
13.根据下表下列叙述中正确的是: ( )
|
序号 |
氧化剂 |
还原剂 |
其它反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
|
③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较: H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
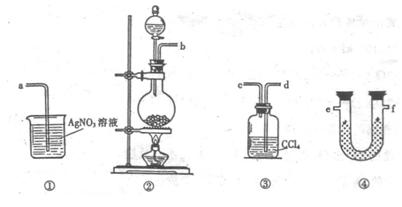
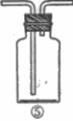 (1)请根据甲同学的意图,连接相应的装置,接口顺序:
(1)请根据甲同学的意图,连接相应的装置,接口顺序: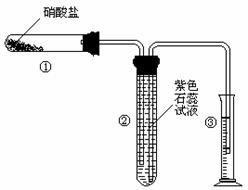
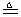 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,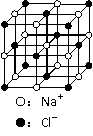 A.在SiO2晶体中,若含有1mol Si原子,则含Si-O
A.在SiO2晶体中,若含有1mol Si原子,则含Si-O