12.下列各组物质中,满足下图物质一步转化关系的选项是 ( )
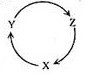
|
选项 |
X |
Y |
Z |
|
A |
NO |
NO2 |
HNO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2SiO3 |
12.下列各组物质中,满足下图物质一步转化关系的选项是 ( )

|
选项 |
X |
Y |
Z |
|
A |
NO |
NO2 |
HNO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2SiO3 |