22.(10分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
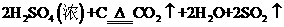
请从下图中选择所需用的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁管、铁架台及加热装置等均略去)
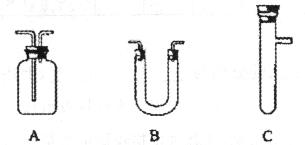
将所选的仪器按连接顺序由上至下依次填入下表,并完成表格相应内容
|
所选用仪器的名称(填字母) |
加入的试剂名称 |
该装置作用 |
|
|
|
反应器(或发生气体) |
|
|
|
检出水 |
|
|
|
检出二氧化硫 |
|
|
酸性高锰酸钾溶液 |
|
|
|
|
检出二氧化碳 |
20.(11分)
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
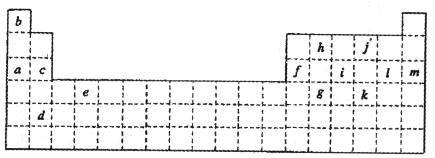
(1)写出g元素在周期表中的位置: 。
(2)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高增化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
试回答下列问题:
I.上述元素中①、②、⑥分别为 ,上述元素中处于第二周期的有 (以上均用元素符号表示)。
II.元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式)。
III.工业上获取⑤单质的主要化学反应方程式为: .
IV.⑤和⑥形成的化合物中化学键是 .
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明)。
 近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中正确的是
近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中正确的是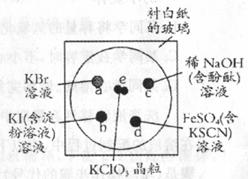 (6分)
(6分)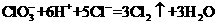 ),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。 



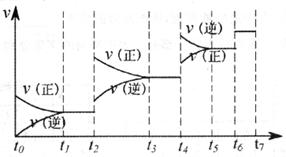
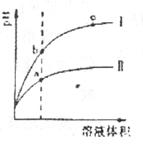 变化的曲线如右图所示。据图判断正确的是
变化的曲线如右图所示。据图判断正确的是