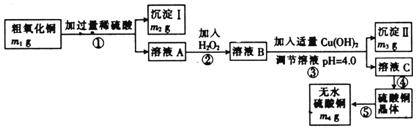
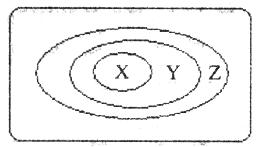
7.用下图表示的一些物质或概念间的从属或包含关系中不正确的
|
|
X |
Y |
Z |
|
A |
氧化物 |
化合物 |
纯净无 |
|
B |
弱电解质 |
电解质 |
化合物 |
|
C |
溶液 |
分散系 |
混合物 |
|
D |
置换反应 |
氧化还原反应 |
离子反应 |
28.(15分)应用化学反应需要研究化学反应的条件、速率和进行的程度。
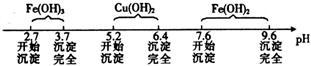
(1)金属与不同浓度的硝酸反应时,往往生成多种不同价态还原产物。图甲是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图。
①某硝酸试剂瓶的标签注明:密度1.26g·mL-1,质量分数50.0%。若取该试剂10mL配成1000mL溶液(250C),所得溶液的物质量浓度为 。
②当硝酸溶液的密度为1.36g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是 (填字母)
a. 2Fe + 10 HNO3 = 2Fe(NO3) 3 + NO↑+ 3NO2↑+ 5H2O
b. 4Fe + 18 HNO3 = 4Fe(NO3) 3 + 3NO↑+ 3NO2↑+ 9H2O
 c. 2Fe + 6 HNO3 = 2Fe(NO3)2 + NO↑+
NO2↑+ 3H2O
c. 2Fe + 6 HNO3 = 2Fe(NO3)2 + NO↑+
NO2↑+ 3H2O
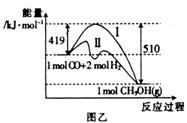
(2)在773K、体积固定的容器内,反应CO(g) + 2H2 (g)  CH3OH(g)过程中能量变化如图乙,其中曲线II表示使用催化剂时的能量变化。若投入a molCO、2a molH2,平衡时能生成0.1a molCH3OH,则反应就有工业应用价值。
CH3OH(g)过程中能量变化如图乙,其中曲线II表示使用催化剂时的能量变化。若投入a molCO、2a molH2,平衡时能生成0.1a molCH3OH,则反应就有工业应用价值。
①若按上述投料比使该反应具有工业应用价值,则CO的平衡转化率最小为 。
②下列有关催化剂的说法中正确的是 (填字母)
a. 使用催化剂,能使反应CO(g) + 2H2 (g)  CH3OH(g)的
CH3OH(g)的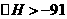 kJ·mol-1
kJ·mol-1
 b. 使用催化剂,能够提高反应物的转化率
b. 使用催化剂,能够提高反应物的转化率
c. 使用催化剂,能够提高单位时间内CH3OH的产量
|
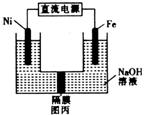
①Fe电极作 (填“阴极”或“阳极”)。
②Ni电极的电极反应式为 。
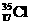 、
、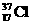 为不同的核素,有不同的化学性质
为不同的核素,有不同的化学性质
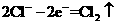
 ④
④ ⑤
⑤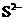 ⑥
⑥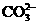 ⑦
⑦ ⑧Mg2+⑨Al3+ ⑩
⑧Mg2+⑨Al3+ ⑩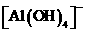 离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是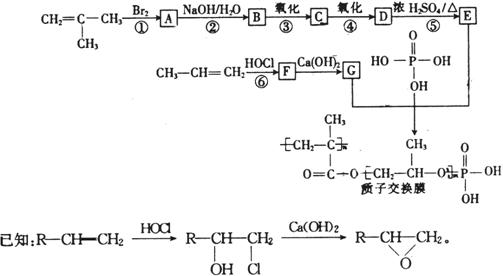
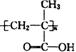 、
、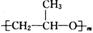 和
和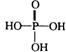 ,它们的物质的量之比为
。
,它们的物质的量之比为
。