25.(14分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Ag+ Na+ |
|
阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。
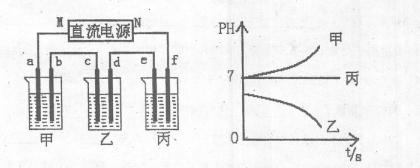
接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 :极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)写出d电极上发生反应的电极反应式 .
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出则该溶液常温时的pH为 。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成原电池,请写出正极的电极反应式: .
(5)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
23.(12分)利用右图装置测定中和热的实验步骤如下: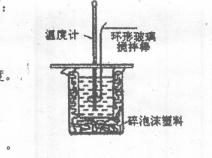
①量取50mL0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)碎泡沫塑料的作用是 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入
C.分三次加入
(3)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数
|
温度 实验次数 |
起始温度t1/℃ |
终止止温度t2/℃ |
温度差(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
(4)若将上述实验步骤中酸和碱的体积都变为60 mL,则放出的热量与上述实验中放出的热量相比 (填变大、变小或不变),中和热 (填变大、变小或不变);若将酸和碱的体积都变为5 mL,则对该实验的主要影响是 。
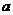 mol钠和
mol钠和 g足量水中,所得溶液密度为
g足量水中,所得溶液密度为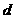 g·mL-1,该溶液中溶质质量分数为 ( )
g·mL-1,该溶液中溶质质量分数为 ( ) B.
B. % C.
% C.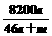 % D.
% D.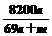 %
%
 反应I:CO(g)+2H2(g) CH3OH(g) △H1
反应I:CO(g)+2H2(g) CH3OH(g) △H1 反应,II:CO2(g)+3H2(g); CH3OH(g)+H2O(g) △H2
反应,II:CO2(g)+3H2(g); CH3OH(g)+H2O(g) △H2