3.下列关于纯净物、混合物、强电解质、电解质和非电解质的组合正确的是 ( )
|
|
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
青铜 |
水煤气 |
硫酸 |
醋酸 |
干冰 |
|
B |
铁红 |
盐酸 |
硫酸钡 |
亚硫酸 |
二氧化硫 |
|
C |
胆矾 |
碘酒 |
苛性钾 |
氢硫酸 |
碳酸钙 |
|
D |
明矾 |
漂白粉 |
氯化钠 |
次氯酸 |
氯气 |
20.(13分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/°C |
终止温度t2/°C |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
试完成下列问题:
(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是
不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
(2)经数据处理,t2-t1=3.4°C。则该实验测得的中和热△H1= [盐酸和NaOH溶液的密度按1 g·cm-3 计算,反应后混合溶液的比热容(c)按4.18 J·(g·°C)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1 △H(填“>”“<”或“=”),理由是
。
(4)在用温度计测得酸溶液的温度后,若未用水洗净就直接测定碱溶液的温度,则计算出的△H (填“偏大”、“偏小”或“无影响”)。

 2009-2010学年度高三年级第一次月考
2009-2010学年度高三年级第一次月考
18.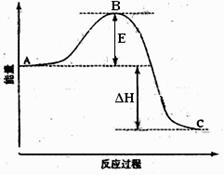 (14分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(14分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降
|
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原
为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循
环机理的化学方程 、 ;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成
3 molSO3(g)的△H
 、Cu
、Cu 、NH4
、NH4 、Al
、Al 、SO4
、SO4
