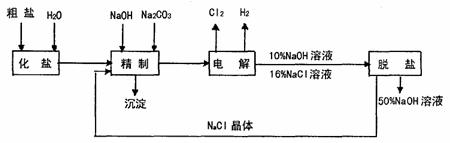
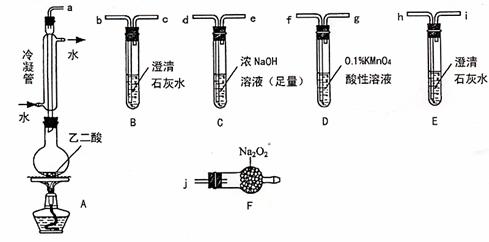
28.(12分)下面是测定硫酸铜晶体水含量的实验,请按要求填空。
(1)加热前应将晶体放在研钵研碎,加热是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失去结晶水的方法是 。
(3)下面是某同学的一次实验数据,请完成计算,将答案填入表中的空格中。
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
测得晶体中结晶水的个数 |
误差(填“偏高”或“偏低”) |
|
11.7g |
22.7g |
18.6g |
|
|
(4)这次实验产生误差的原因可能是 (填字母的序号)。
A.硫酸铜晶体中含有挥发性的杂质
B.加热过程中有晶体溅出
C.实验前晶体表面有湿存水
D.最后两次称量质量相差较大
24.(12分)某100mL溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),
且各离子的物质的量均为0.1mol。
|
阴离子 |
SO2-4、NO-3、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH+4、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
③若向原溶液中加入BaCl2溶液,有白色沉淀生成
试回答下列问题:
(1)原溶液中所含阳离子是(填离子符号,下同) ,阴离子是 。
(2)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验中发生的所有反应的离子方程式是 。
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤后将沉淀洗涤、灼烧,最终所得固体的质量是 。