0 41042 41050 41056 41060 41066 41068 41072 41078 41080 41086 41092 41096 41098 41102 41108 41110 41116 41120 41122 41126 41128 41132 41134 41136 41137 41138 41140 41141 41142 41144 41146 41150 41152 41156 41158 41162 41168 41170 41176 41180 41182 41186 41192 41198 41200 41206 41210 41212 41218 41222 41228 41236 447348
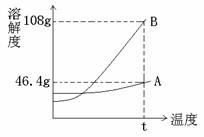
 溶液中,逐滴加入
溶液中,逐滴加入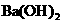 溶液至中性,写出发生反应的离子方程式:___________________________
_________.
溶液至中性,写出发生反应的离子方程式:___________________________
_________.