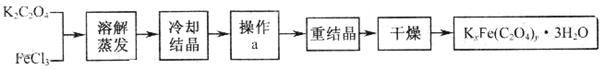
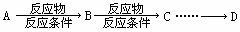16.(12分)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式:
②反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
(3).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
 已知:C3H8(g)
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g); △H1=156.6 kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1=156.6 kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_________;放电时,CO32- 移向电池的_______(填“正”或“负”)极。
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)_____c(CO32-)
(填“>”、“=”或“<”),原因是_______________________(用文字说明)。
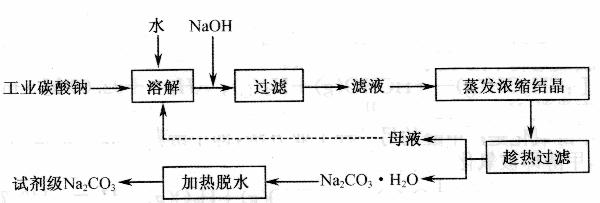
14. ( 12分)工业碳酸钠(纯度约为 98 % )中含有 Ca2+、 Mg2+、 Fe3+、 Cl-和 SO42-等杂质,提纯工艺线路如下:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
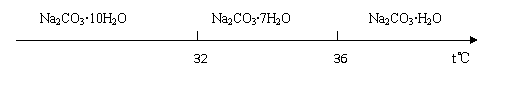

Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1) 加入NaOH溶液时,反应的离子方程式为 。
向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg 2+)∶c(Fe3+)==
( 2 ) “母液”中除了含有 Na+、 CO32-离子外 ,还含有 等离子。
( 3 )有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析实际工业生产中是否可行 (填“可行”或“不可行”)并说明理由 。
( 4 )已知: Na2CO3 ·10H2O ( s ) ==Na2CO3 ( s ) + 10H2O ( g ) △H==+532 .36 kJ·mol-1
Na2CO3 ·10H2O ( s ) ==Na2CO3·H2O ( s ) + 9H2 O( g ) : △H =+473 . 63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
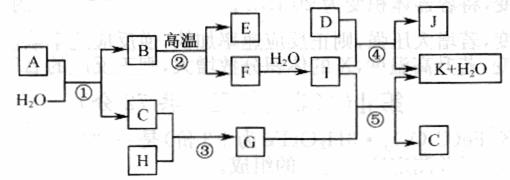
 (10分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
(10分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为: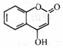 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: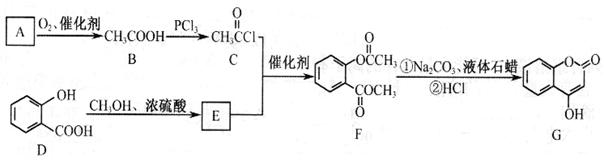
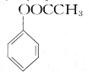 )(用合成路线流程图表示,并注明反应条件)。提示: ① 合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:
)(用合成路线流程图表示,并注明反应条件)。提示: ① 合成过程中无机试剂任选;②合成反应流程图表示方法示例如下: