26.(14分)(1)燃料在电池中直接氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式。
负极_______________________________,
正极_______________________________,
总反应式___________________________。
(2)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:
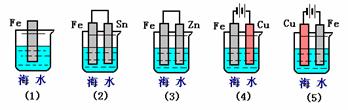
II.①某同学用碳棒、铜棒和稀硫酸为原材
料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
|
|
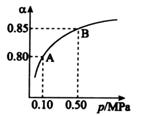
 2SO3(g)。某温度下,SO2的平衡转化率(
2SO3(g)。某温度下,SO2的平衡转化率(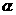 )与体系总压强(
)与体系总压强(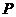 )的关系如图所示。根据图示回答下列问题:
)的关系如图所示。根据图示回答下列问题:
①将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10Mpa。该反应的平衡常数等于______________。
②平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”、“=”)。
(2)用CH4催化还原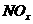 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
 CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2(g);△H=-574kJ·mol-1
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2(g);△H=-574kJ·mol-1
 CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为_______(阿伏加德罗常数的值用NA表示),放出的热量为__________KJ。
(3)新型纳米材料氧缺位铁酸盐(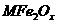 ,
,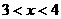 ,M=Mn、Co、Zn或Ni)由铁酸盐(Mfe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
,M=Mn、Co、Zn或Ni)由铁酸盐(Mfe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
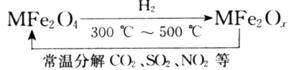
请写出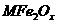 分解SO2的化学方程式_____________________________(不必配平)。
分解SO2的化学方程式_____________________________(不必配平)。
24.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
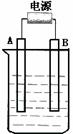 (1)A接的是电源的
极,B是该装置的 极。
(1)A接的是电源的
极,B是该装置的 极。
(2)写出电解时反应的总离子方程式
。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解
前的状态,则需加入 (假设电解前后溶液的体积不变)
|
|
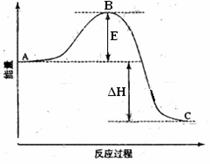 25.(8分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
25.(8分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。
(2)图中△H= KJ·mol-1;
(3)该反应通常用V2O5作催化剂,V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
22.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
第Ⅱ卷 非选择题(共56分)
20、H2和CO2在高温下发生发应:CO2(g)+H2(g) CO(g)+H2O(g)。下表是9860C时,在容积不变的密闭容器中进行反应的四组数据:
CO(g)+H2O(g)。下表是9860C时,在容积不变的密闭容器中进行反应的四组数据:
|
编号 |
起始浓度/mol·L-1 |
平衡浓度/mol·L-1 |
||||||
|
c0(H2) |
c0 (CO2) |
c0 (H2O) |
c0 (CO) |
[H2] |
[CO2] |
[H2O] |
[CO] |
|
|
1 |
1.0 |
1.0 |
0 |
0 |
0.44 |
0.44 |
0.56 |
0.56 |
|
2 |
1.0 |
2.0 |
0 |
0. |
0.27 |
1.27 |
0.73 |
0.73 |
|
3 |
0 |
0 |
2.0 |
2.0 |
0.88 |
0.88 |
1.12 |
1.12 |
|
4 |
0.2 |
0.4 |
0.6 |
0.8 |
0.344 |
0.544 |
0.456 |
0.656 |
下列叙述中正确的是( )。
①该温度下反应的平衡常数约为1.6;②该反应的平衡常数与反应的起始浓度无关;③增大CO2的起始浓度,可使CO2的转化率增大;④从反应开始至达到平衡状态,混合气体的密度没有发生改变。
A. ②③ B. ①②③ C. ①②④ D.①③
16、汽车尾气净化中的一个反应如下:

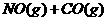

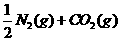

在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:( )
|
|
 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为: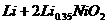

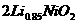 下列说法不正确的是( )
下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e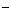 =Li
=Li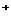
B.充电时,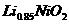 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li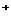 向负极移动
向负极移动
 qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空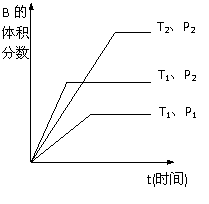 (①、②、③题填“>”、“<”或“=”):
(①、②、③题填“>”、“<”或“=”):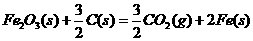 △
△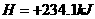 ·
·
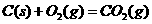 △
△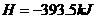 ·
· ①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量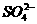 = PbSO4+2e-
= PbSO4+2e-