27.(14分)
(1)H2SO4………………………………………………………………………………(2分)
①S(s)+O2(g) SO2(g);△H=-297kJ/mol(有“点燃”条件给分)………(3分)
②D………………………………………………………………………………………(2分)
|
|
②SO2+2CO S+2CO2……………………………………………………………(3分)
|
(2)2Al+Fe2O3 AlO2O3+2Fe………………………………………………………(2分)
(3)2H2O+O2+4e- 4OH-…………………………………………………………(2分)
(4)Al-3e- Al3+……………………………………………………………………(2分)
铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能。…………………………………………………………………………(3分)
(5)27.2………………………………………………………………………………(3分)
理科综合能力试题
26.(17分)
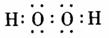 (1)KClO3……………………………………………………………………………(2分)
(1)KClO3……………………………………………………………………………(2分)
…………………………………………………………(2分)
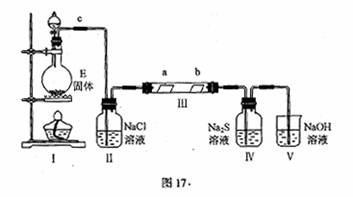
(2)①关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段水柱,则证明I气密性良好。
|
②MnO2+4H++2Cl- Mn2++Cl2↑+2H2O…………………………………………(2分)
③S2-+Cl2=S↓+2 Cl-……………………………………………………………………(2分)
④II III…………………………………………………………………………………(2分)
除去氯气中的水蒸气(或干燥氯气)…………………………………………………(2分)
(3)Cl2+H2O2 2HCl+O2………………………………………………………………(2分)
27.(14分)X、Y、Z为原子序数由小到大排列的三种短周期元素。已知:X、Y的气态氢化物分子具有相同的电数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨。
请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料。W的化学式为 ;
工业制造W的生产过程主要分为三个阶段。
①D 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式 ;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压。从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母) ;
A.400℃~500℃ 10 MPa B.400℃~500℃ 1 MPa
C.500℃~500℃ 10 MPa D.400℃~500℃ 0.1 MPa
 压强/MPa 压强/MPa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
。
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂。
①写出X单质与W的浓溶液反应的化学方程式 ;
②500℃,11.2 L(标准状况)ZY2在催化剂作用下与XY发生化学反应。若有2×6.02×1023个电子转移时,该反应的化学方程式是 。
 (2)①③④…………………………………………………………………………(2分)
(2)①③④…………………………………………………………………………(2分)
 OH
OH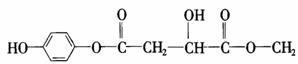 (4)HOOC-CH2-CH-COOH
HOOC-CH=CH-COOH+H2O……(3分)
(4)HOOC-CH2-CH-COOH
HOOC-CH=CH-COOH+H2O……(3分)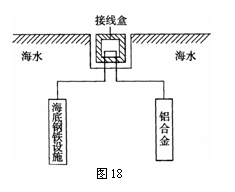 (4)在海洋工程上,通常用铝合金(Al-Zn-Cd)
(4)在海洋工程上,通常用铝合金(Al-Zn-Cd) 2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是 ( )
2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是 ( )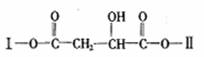 25.(15分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为
25.(15分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为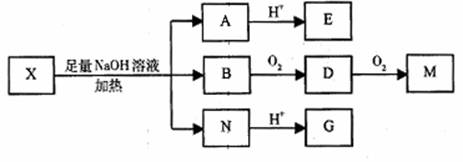
 26.(17分)已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在图16转化中E均起催化作用(某些产物已略去)。
26.(17分)已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在图16转化中E均起催化作用(某些产物已略去)。