23.(14分)已知:
|


|




 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
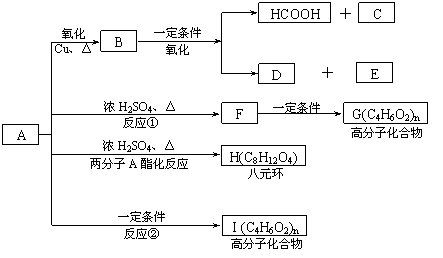 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式:A____________C____________D____________。
(2)反应①和②的反应类型:反应①____________ 反应②____________
(3)写出下列变化的化学方程式:
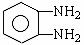 ①E与邻苯二胺(
)缩聚生成一种合成纤维:
①E与邻苯二胺(
)缩聚生成一种合成纤维:
②F→G_________________________________________________
③A→H_________________________________________________
(二)催化效果比较
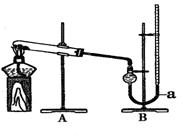 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验 |
KClO3质量 |
其它物质的量 |
待测数据 |
|
实验Ⅰ |
1.2g |
无其他物质 |
|
|
实验Ⅱ |
1.2g |
CuO 0.5g |
|
|
实验Ⅲ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)上表所列实验中的“待测数据”指
(4)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,
(5)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a. ,b.检验CuO的化学性质有没有改变。
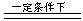 4NO + 6H2O,
4NO + 6H2O, 已知:
已知: